Perkembangan Konsep Reaksi Oksidasi Reduksi
Ada beberapa konsep reaksi oksidasi reduksi, antara lain:
Konsep I:
Reaksi Oksidasi adalah reaksi antara suatu zat dengan oksigen.
Contoh :
2Mg(s) + O2(g) → 2MgO(g)
CH4(g) + O2(g) → CO2(g) + 2H2O(g)
Reaksi Reduksi adalah reaksi pelepasan oksigen dari suatu zat
Contoh :
FeO(s) + CO(g) → Fe(s) + CO2(g)
CuO(s) + H2(g) → Cu(s) + H2O(g)
Konsep II :
Oksidasi adalah pelepasan elektron.
Contoh :
Fe2+ → Fe3+ + 3e
Ca → Ca2+ + 2e
Reduksi adalah penerimaan elektron.
Contoh :
Cu2+ + 2e → Cu
Cl2 + 2e → 2Cl–
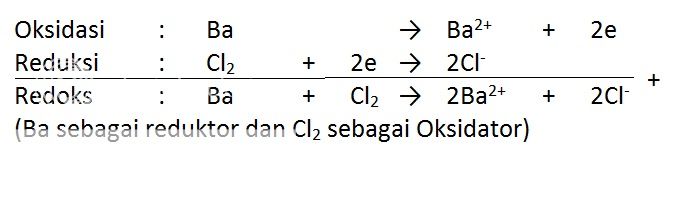
Jika pada suatu reaksi ada zat yang mengalami oksidasi, tentu disertai adanya zat yang mengalami reduksi, demikian pula sebaliknya.
Dengan demikian, zat yang mengalami oksidasi dapat mereduksi zat lain (disebut reduktor), dan zat yang mengalami reduksi dapat mengoksidasi zat lain (disebut oksidator).
Dalam reaksi redoks, banyaknya elektron yang dilepaskan oleh zat reduktor sama dengan banyaknya elektron yang diterima oleh zat oksidator.
Contoh:
Konsep III :
Oksidasi adalah pertambahan bilangan oksidasi(BO/Biloks).
Contoh :
Reduksi adalah pengurangan bilangan oksidasi (BO/Biloks)
Contoh :
Reaksi reduksi dan oksidasi terjadi pada saat yang bersamaan yang dikenal dengan reaksi redoks. Bila satu jenis zat mengalami redoks, maka disebut autoredoks/disproporsionasi.
Contoh :




2 comments