Rangkuman Materi Termokimia
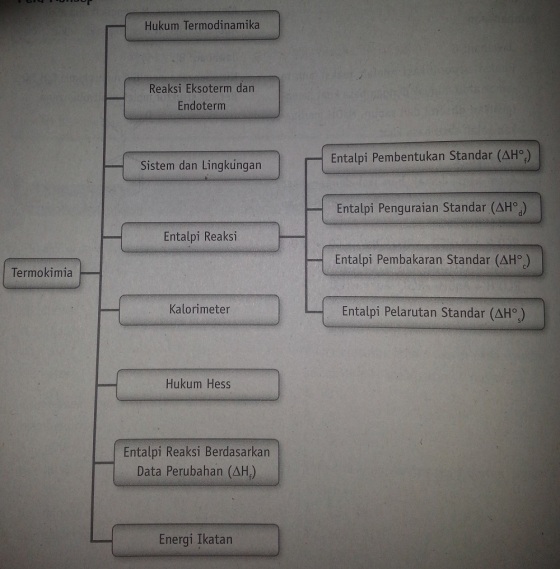
Peta Konsep
A. Hukum Termokimia
- Azas kekekalan energi menyatakan bahwa energi tidak dapat diciptakan maupun dimusnahkan tetapi energi dapat diubah dari satu bentuk ke bentuk lain.
- Jumlah energi yang dimiliki sistem dinyatakan dengan energi dalam (E).
- Jika sistem menyerap kalor, maka E > 0 sedangkan jika sistem membebaskan kalor, maka E < 0
- Hubungan antara energi dalam. kalor dan keda diumuskan dalam hukum termodinamika.
- ΔE = q + W
Keterangan:
ΔE = perubahan energi dalam
q = jumlah kalor yang diserap atau dilepas sistem
q =+ jika sistem menyerap / menerima kalor
q = – jika sistem melepaskan kalor
w = jumlah kalor yang diterima/dRakukan sistem
w =+ jika sistem menerima kera
w = – jika sistem melakukan kerja
B. Sistem dan Lingkungan
- Sistem adalah sejumlah zat atau campuran yang di pelajari sifat-sifat dan perilakunya (bagian dari alam semesta yang sedang jadi pusat perhatian). Sedangkan lingkungan adalah segala sesuatu di luar sistem.
- Interaksi antara sistem dan lingkungan dapat berupa pertuakaran materi dan energi.
(baca juga artikel
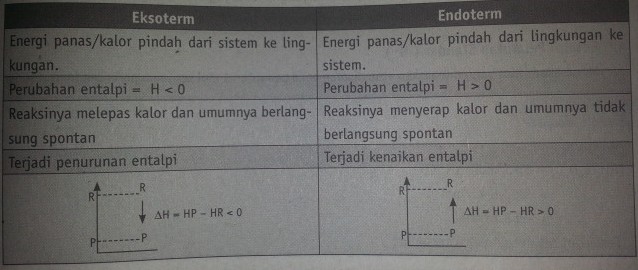
C. Reaksi Eksoterm dan Endoterm
Tabel 7.1 Perbedaan Reaksi Eksotem dan Endoterm
(baca juga artikel kenali perbedaan reaksi eksoterm dan reaksi endoterm dengan mudah )
D. Entalpi Reaksi
Perubahan entalpi (ΔH) diukur pada keadaan standar yaitu perubahan entalpi diukur pada suhu 25°C dan tekanan 1 atm yang disebut dengan perubahan entalpi standar (Ho).
Persamaan reaksi yang mengikutsertakan H reaksi disebut persamaan termokimia, contohnya:
2 H2 + O2 → H2O
H= -404 kJ/mol
Artinya: 2 mol gas H2, bereaksi dengan 1 mol gas O2, menghasilkan 2 mol H2O dengan melepas kalor sebesar 404 kl/mol.
E. Perubahan Entalpi Reaksi standar
1. Entalpi Pembentukan Standar (Hof)
Merupakan kalor reaksi yang diperlukan atau dilepaskan pada pembentukan 1 mol senyawa dari unsur-unsurnya pada keadaan standar.
H2 + 1/2 O2 → H2O
H= -285,8 kJ/mol
Artinya: 1 mol gas H2 bereaksi dengan 1/2 mol gas O2 menghasilkan 1 mol H2O dengan melepas kalor sebesar 285,8 kJ/mol
2. Entalpi Penguraian Standar (Hod)
Merupakan kalor yang dilepaskan atau diserap pada penguraian 1 mol senyawa menjadi unsur-
unsurnya pada keadaan standar. Contoh:
H2O → H2 + 1/2 O2
H = +285,8 kJ/mol
Artinya: Untuk menguraikan 1 mol H2O menjadi 1 mol gas H2 dan mol gas O2 dibutuhkan kalor sebesar 285,8 kJ/mol.
3. Entalpi Pembakaran Standar (Hoc)
Merupakan kalor yang dilepaskan pada pembakaran 1 mol zat pada keadaan standar. Pada reaksi pembakaran selalu dihasilkan gas CO2 dan H2O yang dikenal juga dengan pembakaran sempurna.
Sedangkan pembakaran tidak sempurna menghasilkan gas CO2 dan H2O.
4. Entalpi Pelarutan Standar (Hos)
Merupakan kalor yang dilepaskan atau diserap pada pelarutan 1 mol senyawa pada keadaan standar.
F. Kalorimeter
Kalorimeter adalah alat yang mengukur kalor yang dilepas ataupun diserap sistem. Pada kalorimeter tidak terjadi perpindahan kalor antara sistem dan lingkungan sehingga berlaku:
Qreaksi = -(Qsistem + Qkalorimeter)
Jumlah kalor yang diserap (ditandai dengan suhu yang turun) atau dibebaskan (ditandai dengan suhu naik) larutan dapat ditemukan dengan pengukur perubahan suhunya. Jumlah kalor yang yang diserap atau dibebaskan dapat dirumuskan:
Q = m.c.ΔT
Keterangan:
Q = kalor yang diserap/dibebaskan (Joule)
m = massa zat (gr)
C = kalor jenis (J/groC)
Δt = perubahan suhu (t2 – t1) oC
G. Hukum Hess
“Kalor reaksi yang dibebaskan ataupun yang diserap tidak tergantung pada jalannya reaksi tetapi tergantung pada keadaan awal dan keadaan akhir reaksi” Artinya perubahan entalpi suatu reaksi tetap sama baik berlangsung dalam satu tahap maupun beberapa tahap. Skema dari hukum Hess:
(baca juga artikel Penentuan Kalor Reaksi Berdasarkan Hukum Hess)
H. Entalpi Reaksi Berdasarkan Data Perubahan
p A + q B → r C + s D
ΔHreaksi = ΔHofhasil – ΔHof pereaksi
ΔHreaksi = (r.ΔHofC + s.ΔHofD) – (p.ΔHofA + q.ΔHofB)
I. Energi Ikatan
Energi Ikatan adalah energi yang diperlukan untuk memutuskan 1 mol senyawa dalam keadaan gas menjadi atom atom gas. Secara Umum :
ΔHreaksi = ΔHofpereaksi – ΔHofhasil
(Baca juga artikel Pembentukan Ion dan Pembentukan Pasangan Elektron Bersama )


3 comments