Materi Pelajaran
11, amonia, amonium, asam, asam belerang, basa, bereaksi, buffer, campuran, hidroksida, ipa, keasaman, kelas, kelas 11, kelas XI, Kimia, konjugasi, kuat, larutan, lemah, liter, lks, log, MIPA, modul, mol, molalitas, molaritas, natrium, pelajaran, penyangga, perbandingan, pH, reaksi, sekolah, senyawa, sulfat
Krisna Dwi Wardhana
3 Comments
Larutan Penyangga (Part 2)
pH larutan penyangga
1. Sistem penyangga asam dengan basa konjugasinya
- Disebut juga buffer asam
- Buffer asam → asam lemah + basa konjugasinya
- Harga pH lebih kecil dari 7 (pH < 7)
- Tergantung dari harga Ka asam lemah dan perbandingan mol asam lemah (nA) dan mol basa konjugasinya (nG).
Contoh :
Hitung pH larutan penyangga yang dibuat dari 100 mL larutan CH3COOH 0,1 M dengan 200 mL CH3COONa 0,1 M (Ka CH3COOH = 105)
Jawab :
CH3COOH = 100 mL x 0,1 mol L-1 = 10 mmol (asam)
CH3COONa = 200 mL x 0,1 mol L-1 = 20 mmol (basa konjugat)
2. Sistem penyangga basa dengan asam konjugasinya
- Disebut juga buffer basa
- Buffer basa → basa lemah + asam konjugasinya
- Harga pH lebih besar dari 7 (pH > 7)
- Tergantung dari harga Kb pada basa lemah dan perbandingan mol basa lemah (nB) serta mol asam konjugasinya (nG)
Contoh :
Dalam 1 liter larutan terdapat 0,01 mol NH3 dan 0,02 mol NH4+ yang berasal dari kristal (NH4)SO4. Jika Kb NH3 = 10-5, maka berapa pH larutan tersebut?
Jawab :
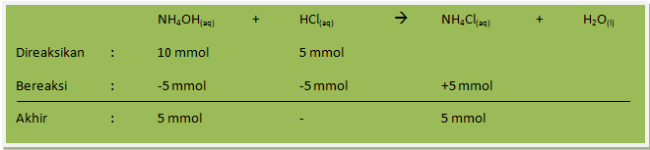
Hitung pH larutan yang dibuat dari campuran 100 mL larutan NH4OH 0,1 M dengan 50 mL larutan HCl 0,1 M (Kb NH4OH = 10-5)
Jawab :
NH4OH = 100 mL x 0,1 mol L-1 = 10 mmol
HCl = 50 mL x 0,1 mol L-1 = 5 mmol
Sumber : Modul Kimia kelas XI
Untuk artikel sebelumnya yaitu larutan penyangga part 1. silahkan klik disini
Latest posts by Krisna Dwi Wardhana (see all)
- Purdue terlibat dalam ekspedisi Amelia Earhart - February 19, 2026
- Mensos Gus Ipul Umumkan Progres Sekolah Rakyat, Siap Layani 30.000 Siswa - February 19, 2026
- Kenaikan Kasus Malaria di Mimika Selama Tiga Tahun Terakhir - February 19, 2026
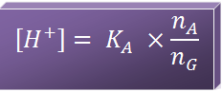

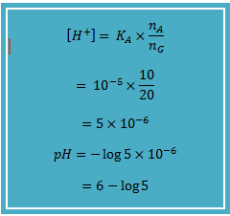
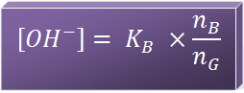
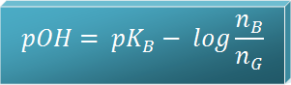

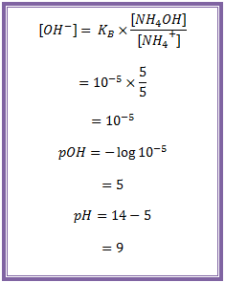



3 comments