
reek سْــــــــــــــــــمِ اللهِ الرَّحْمَنِ الرَّحِيْمِ
Assalamualaikum w.r.b. teman-teman 😉
Slamat datang di bisakimia.com insyaallah pasti bisa 🙂
Ä . KONSEP ASAM BASA
- Teori asam basa Arrhenius
Menurut Arrhenius asam adalah zat yang dapat melepaskan ion H+ didalam air sehingga konsentrasi ion H+ dalam air meningkat .Sedangkan basa adalah zat yang dapat melepaskan ion OH – didalam air sehingga konsentrasi ion OH– dalam air meningkat .
∴ Contoh senyawa yang tergolong asam dan basa menurut teori arrhenius adalah sbb ;
a. Asam : HCl , HNO3 dan H2SO4 senyawa ini jika dilarutkan dalam air akan terurai membentuk ion H+ dari ion negatif sisa asam
HCl(g)→ H+(aq) + Cl –(aq)
HBr(g)→ H+(aq) + Br –(aq)
b. Basa : NaOH , KOH , Ca(OH)2 ,dan Al(OH)3 senyawa ini jika dilarutkan dalam air air akan terurai membentuk ion OH – dari ion positif sisa basa
NaOH(aq) → Na+(aq) + OH–(aq)
KOH(aq) → K+(aq) + OH–(aq)
Menurut teori arrhenius , rumus kimia asam harus mengandung gugus hidroksil (OH– )
Kekurangan teori arrhenius :
- hanya dapat diaplikasikan dalam reaksi yang terjadi didalam air
- tidak menjelaskan mengapa beberapa senyawa yang mengandung hidrogen dengan biloks +1 (seperti HCl) larut dalam air untuk membentuk larutan asam , sedangkan yang lain seperti CH4 tidak .
- tidak dapat menjelaskan mengapa senyawa yang tidak memiliki OH– seperti Na2CO3 memiliki karakteristik seperti biasa
2. Teori asam basa Browsed – Lowry
Menurut teori asam basa Browsed – Lowry, asam adalah spesi yang memberikan proton (donor proton), sedangkan basa adalah spesi yang menerima proton (akseptor proton ) . Konsep asam basa Browsed – Lowry, dapat mengatasii kelemahan teori asam basa Arrhenius
kelebihan teori asam basa Browsed – Lowry
- konsep asam basa Browsed – Lowry tidak terbatas pada ppelarut air , tetapi juga menjelaska reaksi asam basa dalam pelarut lain / bahkan reaksi tanpa pelarut .
- konsep asam basa Browsed – Lowry tidak hanya berupa molekul , tetapi juga berupa kation/anion . Konsep asam basa Browsed – Lowry dapat menjelaskan sifat asam NH4Cl
Dalam NH4Cl, yang bersifat asam adalah ion NH4+ karena dalam air dapat melepas proton .
NH4+ + H2O⇔ NH3 + H3O+
suatu asam telah melepas satu proton akan membentuk spesi yang disebut basa konjugasi dari asam tersebut . Sedangkan basa yang telah menerima proton menjadi asam konjugasi
example :
- tentukan pasangan asam basa konjugasi dari reaksi berikut !
NH3(aq) + H2O(l)⇔ NH4+(aq) + OH–(aq)
Penyelesaian :
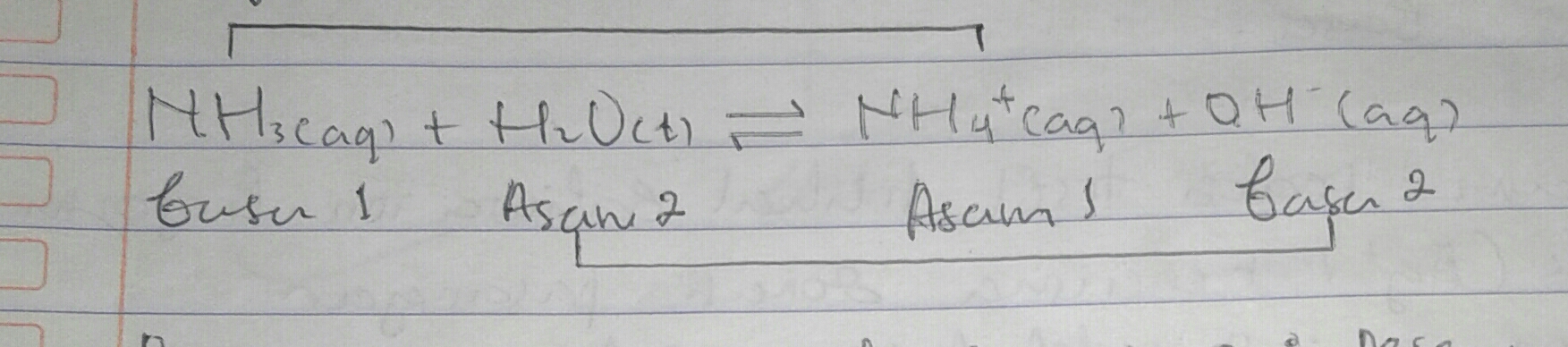
pasangan asam basa konjugasi dari persamaan diatas adalah H2O/ OH– dan NH4+ / NH3
3. Teori asam basa Lewis
Menurut teori asam basa Lewis. asam adalah spesi yang mampu menerima pasangan elektron (akseptor elektron) . Sedangkan basa adalah spesi yang mampu memberikan sepasang elektron (donor elektron).
example :

Kelebihan Teori asam basa Lewis :
-
Teori Lewis dapat menjelaskan reaksi asam basa yang berlangsung dalam pelarut air , pelarut bukan air ,dan tanpa pelarut sama sekali .
-
Teori Lewis dapat menjelaskan reaksi asam basa yang tidak melibatkan transfer proton ( H+) , seperti reaksi antara BF3 dan NH3
-
Teori Lewis dapat menjelaskan reaksi-reaksi seperti pembentukan ion kompleks dan reaksi-reaksi dalam kimia organik sebagai reaksi asam basa
example :
Ag+ + 2 : NH3 → ( H3N : Ag : NH3)+
asam basa
dalam reaksi tersebut terlihat bahwa ion logam perak (Ag+) menerima donasi pasangan elektron dari dua molekul NH3 . Sehingga ion logam perak bertindak sebagai asam, sedangkan molekul NH3 bertindak sebagai basa .
setelah terjadi reaksi asam basa tersebu dua komponen { ion loga, Ag dan molekul NH3 } berikatan menjadi satu senyawa ion kompleks .
bah .. itu tadi adalah ringkasan konsep asam basa dari Arhenius, Browsed-Lowry dan juga Lewis . Semoga bermanfaat , keep spirit and wassalamualaikum rek ^-^



