Larutan Penyangga (Part 3)
Editor’s note: artikel ini merupakan lanjutan dari bagian 1 dan bagian 2.
Daya penahan larutan penyangga
Pada dasarnya suatu larutan yang tersusun dari asam lemah dan basa konjugasi merupakan suatu sistem kesetimbangan dalam air, yang melibatkan kesetimbangan air dan asam lemah. Penambahan larutan asam lemah atau basa ke dalam suatu larutan penyangga dalam batas-batas tertentu dapat dipertahankan, tetapi pada penambahan yang berlebihan atau pengenceran yang berlebihan tetap akan mengalami perubahan.
Contoh:
Dalam 1 liter larutan penyangga yang mengandung larutan CH3COOH 0,1M dan CH3COO– 0,1 M ditambahkan 10 mL larutan HCl 0,1M. (Ka CH3COOH = 10-5) Tentukan pH larutan penyangga :
- Sebelum ditambah HCl dan
- Setelah ditambah HCl
Jawab :
1. Sebelum ditambah HCl
2. Setelah ditambah HCl
Jumlah mol sebelum ditambah HCl
CH3COOH = 0,1 mol/L x 1 L = 0,1 mol
CH3COO– = 0,1 mol/L x 1 L = 0,1 mol
HCl yang ditambahkan = 0,1 mol/L x 0,01 L = 0,01 mol
Jumlah mol H+ = 0,01 mol
Pada penambahan HCl, ion H+ dari HCl bereaksi dengan ion CH3COO–,
CH3COO– + H+ → CH3COOH
Sehingga jumlah mol :
CH3COOH = 0,1 + 0,001 mol = 0,101 mol
CH3COO– = 0,1 – 0,001 mol = 0,099 mol
Maka
pH = 5- log 1,02
maka perubahan pH yang terhadi sebesar 0,005.
Larutan penyangga dalam kehidupan sehari-hari
Reaksi kimia yang terjadi dalam tubuh manusia melibatkan enzim sebagai katalisator yang hanya dapat bekerja dengan baik pada pH tertentu (pH optimumnya) sehingga diperlukan adanya pH yang relatif tetap. Di dalam tubuh terdapat pasangan asam-basa konjugasi yang berfungsi sebagai larutan penyangga untuk mempertahankan harga pH.
Contoh sistem penyangga dalam tubuh :
- Penyangga karbonat (H2CO3/HCO3), berfungsi untuk menjaga pH darah (ekstra sel)
- Penyangga fosfat (H2PO4/HPO4), berfungsi menjaga pH cairan intra sel
- Penyangga asam amino/protein.
Apabila mekanisme pengaturan pH dalam tubuh gagal (dapat terjadi saat kira sakit jantung, ginjal, diabetes, diare terus menerus) maka pH dapat turun ke bawah 7 atau naik di atas 7,8 sehingga menyebabkan kerusakan permanen pada organ tubuh atau bahkan kematian.
Sumber : Modul kimia kelas XI

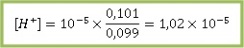

1 comment