Materi Pelajaran
anion, antar, atom, cairan, Chemical polarity, dipol, dispersi, Electronegativity, gaya antar molekul, gaya despersi, gaya dipol, gaya intramolekul, gaya tolak, Hydrogen bond, ikatan hidrogen, ikatan kimia, ion, materi kimia, Materi pelajaran, Molecule, momendipol, polar, Properties of water, senyawa, tarik menarik, water
krisnadwi
1 Comments
Mempelajari Gaya Antarmolekul dengan Mudah
Jika sebelumnya kita telah membahas tentang ikatan kimia , kali ini kita akan mempelajari gaya antarmolekul. Apa itu gaya antar molekul? seperti dari namanya, gaya antarmolekul ialah gaya tarik antar molekul. Ingat ya, Antarmolekul bukan intramolekul. kalau intramolekul, untuk di dalam molekul itu sendiri. Gaya antarmolekul ini menentukan keberadaan materi terkondensasi-cairan dan padatan. Umumnya gaya antarmolekul jauh lebih lemah daripada gaya intramolekul. Jadi biasanya diperlukan energi yang lebih kecil untuk menguapkan cairan daripada untuk memutuskan ikatan dalam molekul cairan. misalnya H-O-H —— H-O-H , ikatan antar H2O lebih mudah putus daripada ikatan antara H dan O didalam 1 molekul H2O
Gaya Dipol-dipol
Gaya dipol-dipol merupakan gaya yang bekerja antara molekul – molekul polar. yaitu antara molekul yang memiliki momen dipol. Semakin besar momen dipolnya, maka sebakin kuat gayanya.

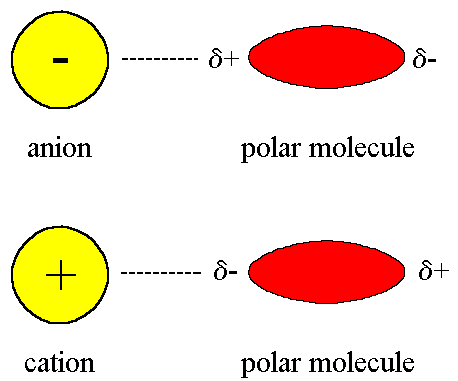
Gaya ion dipol
Gaya ion dipol ini mirip seperti gaya dipol dipol, bedanya disini ialah interaksinya antara molekul polar dan ion (bisa kation atau anion). Kekuatan interaksi bergantung pada muatan dan ukuran ion dan pada besarnya momen dipol dan ukuran molekul. Muatan kation umumnya lebih terpusat, karena kation biasanya lebih kecil daripada anion. Jadi, untuk muatan yang sama, kation berinteraksi yang lebih kuat dari anion.
Gaya Dispersi
dua gaya diatas yang telah dibahas ialah gaya untuk molekul polar. lalu bagaimana dengan molekul non polar? Gaya dispersi ialah jawabannya. gaya dispersi ialah gaya tarik menarik yang timbul sebagai hasil dipol dipol yang terinduksi sementara dalam atom atau molekul. Pasti akan timbul pertanyaan baru lagi. apakah yang dimaksud dengan dipol yang terinduksi sementara? Jadi, ketika ada molekul non polar berdekatan dengan suatu molekul polar. Kesetimbangan distribusi muatan di dalam molekul tersebut akan terganggu akibat mleku polar. Sehingga sifat elektrostatisnya ‘tertular’ atau terinduksi dari molekul polar dan hanya bersifat sementara.
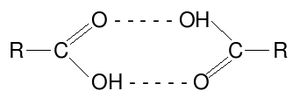
Ikatan Hidrogen
Ikatan hidrogen adalah jenis khusus interaksi dipol dipol antara atom hidrogen dalam ikatan polar, seperti N-H, O-H, atau F-H, dengan atom elektronegatif O, N atau F. Energi rata rata satu ikatn hidrogen cukup besar untuk satu interaksi dipol dipol (hingga 40 kJ/mol). Jadi, ikatanj hidrogen merupakan suatu gaya yang kuat dalam menentukan struktur atau sifat dari banyak senyawa. Bukti awal adanya ikatan hidrogen berasal dari kajian mengenai titik didih senyawa. Misalnya saja H2O, yang memiliki ikatan hidrogen O-H. titik didihnya 100C. Kekuatan ikatan hidrogen ditentukan ditentukan oleh interaksi coulomb antara pasangan elektron bebas pada atom elektronegatif dan inti hidrogen.
Gaya antarmolekul yang dibahas semuanya bersifat tarik menarik. namun harap diingat bahwa molekul juga melakukan gaya tolak menolak satu sama lain. Ketika dua molekulnya berdekatan, gaya tolak antara muatan yang sama timbul. dan semakin dekat, makan akan semakin tinggi energi tolaknya. Oleh karena itu akan dibutuhkan energi yang lebih tinggi untuk memampatkan suatu molekul.
Sumber : Chang, Raymond. 2004. Kimia Dasar: Konsep – Konsep Inti. Erlangga: Jakarta

1 comment