Materi Pelajaran
atom, atom c, aturan oktet, Dan (rank), elektron, ikatan kimia, ikatan kovalen, Jonghyun, Kali, Karena, kovalen, lalu, lambang, lambang titik lewis, lewis, mari kita, non polar, oktet, polar, postulat lewis, resonansi, Salah, SlideShare, struktur lewis, tabel periodik, tiap, titik
Krisna Dwi Wardhana
1 Comments
Memahami Ikatan Kovalen Lebih dalam
Sebelumnya telah dibahas di bisakimia.com tentang ikatan kimia yang temasuk di dalamnya membahas tentang ikatan kovalen, Lalu juga telah dibahas tersendiri tentang ikatan Kovalen yang menjelaskan beberapa jenis ikatan rangkapnya. Kali ini bisakimia.com akan membahas lebih jauh tentang ikatan kovalen mengenai sifat sifat yang berhubungan ikatan kovalen.
Telah dijelaskan bahwa Ikatan Kovalen terjadi berdasarkan postulat lewis, yang terbentuk akibat adanya penggunaaan bersama beberap pasang elektron oleh beberapa atom. Karena itu kita harus memahami tentang struktur lewis mulai dari penggambarannya juga. dalam penggambaran dikenal Lambang titik Lewis, Lambang titik lewis terdiri dari lambang unsur dan titik – titik yang setiap titiknya menggambarkan setiap elektron valensi dari atom unsur. Hal inilah yang mendasari uruan tabel periodik. Mari kita lihat contoh di bawah ini

Gambar tersebut telihat bahwa C memiliki 4 titik yang mewakili jumlah elektron valensinya. Mari kita buktikan, C memiliki nomor atom 6. Maka C6 : 1s2 2s4
Lalu bagaimana Jika terjadi ikatan kovalen dengan menggambarkan lambang titik lewis. Mari kita coba lihat pada gambar CH4 dibawah. C yang memiliki 4 titik, masing – masing akan dipakai bersama oleh atom C dan H yang datang mengisi kekosongan dari C

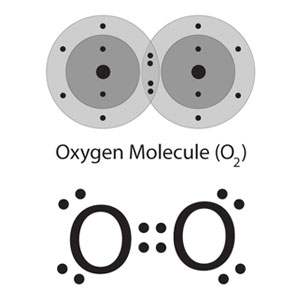
Atom C pada gambar bisa menerima 4 elektron dari H karena tiap elektron valensi dari C berupa elektron tak berpasangan. Bagaimana dengan Elektron berpasangan? Elektron berpasangan tidak dapat menerima elektron lagi sehingga tidak akan terjadi ikatan kovalen. Lihat saja pada atom Oksigen berikut
Ikatan Kovalen Polar dan Non Polar
Masalah kepolaran sebelumnya telah dibahas juga pada artikel memahami kepolaran senyawa, namun pada kali ini kita akan membahas bagaimana hubungan antara kovalen dengan kepolaran. Seperti yang telah kita ketahui tentang kepolaran ialah suatu sifat yang terjadi akibat perbedaan keelektronegatifan suatu atom. Atom yang lebih elektro negatif cenderung menarik elektron dari atom lain pada molekulnya. Misalnya saja H2O , H2O merupakan contoh ikatan kovalen polar karena atom O yang cenderung elektronegatif dibanding dengan atom H. Sebaliknya pada senyawa O2, yang terjadi ialah ikatan kovalen non polar karena tak ada kecenderungan penarikan elektron dari satu atom ke atom yang lainnya. tarikan antara atom Oksigen identik sehingga tak terbentuk kutub kutub tarikan elektron
Muatan Formal dan Struktur Lewis
Dalam suatu molekul, Atom atom memiliki kestabilan tersediri. Salah satu yang mempengaruhinya ialah muatan formal. Muatan formal suatu atom adalah jumlah elektron valensi dalam atom bebas dikurangi jumlah elektron yang dimiliki oleh atom tersebut di dalam struktur lewis. Untuk lebih jelasnya bisa dilihat pada gambar dibawah

Pada struktur 1 , muatan atom Oksigen memiliki muatan formal -1. jika dihitung sesuai definisi maka elektron valensi O dikurang jumlah elektron pada struktur lewis maka : 6 – 7 = 1 . begitu pula dengan yang lainnya. Muatan Molekul merupakan penjumlahan dari muatan formal atom atom di dalamnya. sehingga molekul N2O tersebut tetap netral walaupun di dalamnya banyak muatan formal yang tidak 0.
Resonansi
Pernahkan anda mendengar tentang resonansi? mari mengenalnya secara singkat. Resonansi ialah sebuah struktur yang menunjukkan dua buah struktur atau lebih yang mengalami perpindahan elektron berulang untuk menstabilkan molekulnya.
NO3 merupakan salah satu senyawa yang mengalami resonansi, elektron terus berpindah pindah bergantian tanpa henti untuk lebih menstabilkan senyawa tersebut. Contoh senyawa lainnya ialah Ozon
Pengecualian Aturan Oktet
Seperti yang telah kita tahu aturan oktet mengatur tentang jumlah ikatan dan elektron dari suatu atom agar tercapai kestabilan. Dalam pengecualian aturan oktet terdapat 3 kategori, yaitu oktet yang tak lengkap, jumlah elektron ganjil dan terdapat lebih 8 elektron di sekitar atom pusat. Untuk pengecualian aturan oktet akan dibahas lebih lanjut di artikel selanjutnya.
Sumber :
http://dkreutz.basd.k12.wi.us
Chang, Raymond. 2004. Kimia Dasar. McGraw-Hill Companies

1 comment