Hukum Pertama Termodinamika : Konsep Konsep
sebuah bagian penting yang tak dapat dipisahkan dari semua hal kompleks yang akan kita pelajari nanti yaiut hal dasar seperti sistem, lingkungan, sistem terbuka ataupun sistem tertutup. komponen komponen tersebutlah yang membentuk konsep dasar seperti kerja, kalor dan energi yang ada untuk menghasilkan berbagai hal lain yang akan muncul lebih lanjut jika dipelajari.
2.1 Kerja, Kalor, dan Energi
Kerja adalah proses yang menghasilkan perubahan. Jika proses itu tidak dapat digunakan untuk menghasilkan perubahan kedudukan sebuah beban, maka proses situ tidak bisa disebut sebagai kerja.
Kalor adalah hasil dari energi yang berubah karena adanya perbedaan temperatur sistem dan temperatur lingkungan. Diatermik adalah peristiwa yang memungkinkan suatu sistem melakukan pemindahan energi sebagai kalor. Sedangkan adiabatik adalah peristiwa yang tidak memungkinkan terjadinya pemindahan energy sebgai kalor
Energi adalah kapasitas sistem untuk melakukan ‘kerja’. Jika kita melakukan kerja pada system yang terisolasi (misalnya dengan memampatkan gas atau dengan memutar pegas), artinya kita menambah kapasitasnya untuk melakukan kerja sehingga menambah energinya. Energi yang dimiliki oleh suatu benda disebut energi dalam. Dilambangkan dengan U.
2.2 Hukum Pertama
Energi dalam adalah energi total dari suatu sistem.
∆U = Uf – Ui
Energi dalam suatu system besarnya tetap, kecuali jika diubah dengan melakukan kerja atau dengan pemanasan.
Dalam eksperimen membuktikan, pertama, energi dalam sistem yang terisolasi adalah tetap. Dengan kata lain, energi bersifat kekal. Bukti kekekalan energi adalah kemustahilan untuk membuat mesin yang bergerak terus menerus bekerja tanpa bahan bakar. Dengan adanya kalor maka dapat mengubah energi dari suatu sistem.
Kerja dan Kalor
2.3 Kerja Mekanisme
Kerja mekanisme adalah kerja yang dilakukan untuk menggerakkan objek sepanjang jarak dz melawan gaya yang menentang F, dengan rumus :
dw = – F dz
tanda negatif berarti jika sistem menggerakkan objek melawan gaya yang menentangnya maka energi dalam sistem turun.
Dalam medan gravitasi, kerja dihitung dengan rumus :
w = – mgh
2.4 Kerja Pemampatan dan Pemuaian
Dalam termodinamika kerja dapat dihitung dengan melihat sistem ketika sistem tersebut memuai. Kerja yang dilakukan jika sistem memuai melalui dv melawan tekanan tetap peks adalah :
dw = – peks dv
pemuaian bebas
pemuaian bebas terjadi jika peks=0 dan tidak ada yang menentang
w = 0
pemuaian melawan tekanan tetap
pemuaian ini terjadi jika tekanan luar peks tetap selama pemuaian, sehingga kerja yang dilakukan sewakyu sistem berjalan secara kuasistatis melalui setiap pemindahan sangat kecil
w = – peks ∆v
pemuaian reversibel
adalah perubahan yang dapat dikembalikan dengan modifikasi sangat kecil dari sebuah variabel. Salah satu contoh dari reversibilitas adalah kesetimbangan termal dua benda pada temperatur sama. Kerja total dari pemuaian reversibel adalah :
pemuaian reversibel isotermal
kerja dalam pemuaian reversibel isotermal dapat diketahui dengan menggunakan persamaan gas ideal
2.5 kalor dan entalpi
Perubahan energi dalam sistem, secara umum :
dU=dq+ dw_e+ dw_eksp
Kalorimetri
alat untuk mengukur dengan menggunakan konsep dasar
q=C×∆T
Entalpi
entalpi yaitu kalor yang diberikan yang sama dengan perubahan dalam sifat termodinamika yang lain dari sistem
H=U+pV
Termokimia
2.6 Perubahan-perubahan entalphi standard
Macam-macam perubahan entalpi standar :
- Entalpi perubahan fisik (Entalpi transisi standar (ΔH°trs))
- Entalpi peleburan standar
- Entalpi sublimasi standar
- Entalpi penguapan
- Entalpi pelarutan standar
- Entalpi perubahan kimia
- Entalpi pembakaran standar
- Entalpi hidrogenasi standar
- Entalpi pengionan { ΔH°i = Ei + RT (T=0)}
*Entalpi perolehan elektron :
E (g) + e⁻(g) à E⁻ (g) ΔH°ea
- Entalpi pembentukan dan disosiasi ikatan
- Entalpi ikatan rata-rata
- Entalpi pengatoman
- Hukum Hess
“Entalpi reaksi secara keseluruhan adalah jumlah entalpi reaksi dan reaksi-reaksi individual yang merupakan bagian dari suatu reaksi.”
2.7 Entalpi Pembentukan
Contoh entalpi pembentukan :
6C(s,gr) + 3H2(g)→C5H6(l) ∆H(C5H6,l)=+49,0kJ/mol
Siklus Born Haber
Contoh Siklus Born Haber
- Na(s)→Na(g) ∆Hosub(Na)
- Na(g)→Na+(g)+ e– (g) ∆Hi(Na)
- ⅟2Cl2(g)→ Cl(g) ⅟2 ∆Ho(Cl-Cl)
- Cl(g)+ e– (g)→ Cl– (g) ∆Hoea(Cl)
- Na+(g)+ Cl–(g) →NaCl(s)
Entalpi reaksi berkenaan dengan entalpi pembentukan
Dengan : Sj= zatEntalpi reaksi, reaksi di samping adalah aA+bB→cC+dD.
Vj= koefisien zat
atau jika menggunakanentalpi reaksinya:
![]() dengan ∆Hof adalah entalpi pembentukan standar zat Sj.
dengan ∆Hof adalah entalpi pembentukan standar zat Sj.
VARIASI ENTALPI DENGAN TEMPERATUR
Entalpi suatu zat bertambah jika zat itu dipanaskan. Berubah dengan perubahan temperatur, bervariasi dengan cara yang khas.
2.8 Kapasitas Kalor Zat
Kapasitas kalor pada volume tetap
Kalor yang diperlukan agar mengubah temperatur dT adalah dqv = CvdT , dengan Cv sebagai kapasitas kalor pada volume tetap. Karena dU = dqv
dU = CvdT pada volume tetap
menyatakan Cv dengan dU/dT dengan volume tetap. Jika satu variabel atau lebih dijaga agar tetap selama perubahan variabel yang lain maka turunannya disebut “turunan parsial”
C_V=(dU/dT)T
Kapasitas kalor pada tekanan tetap
Kalor yang diperlukan agar menghasilkan perubahan temperatur yang sama adalah dqp = Cp dT, dengan Cp menyatakan kapasitas kalor pada tekanan tetap. Dalam hal ini, sistem dapat mengubah volumenya, sehingga sejumlah energi yang diberikan sebagai kalor dapat dikembalikan ke lingkungannya sebagai kerja dan tidak khusus digunakan untuk menaikkan temperatur sistem. Secara umum Cv berbeda dengan Cv berbeda dengan Cp. Karena dqp = dH, maka
C_p=(dU/dT)p
Ini definisi Cp
Karena kerja pemuaian dilakukan pada tekanan luar tetap, untuk pemberian kalor tertentu, kenaikan temperatur pada tekanan tetap lebih kecil daripada kenaikan temperatur pada volume tetap. Hubungan sederhana antara kedua kapasitas kalor gas sempurna sebagai berikut:
Cp – Cv = nR
2.9 Ketergantungan entalpi reaksi terhadap temperatur
Jika perubahan temperatur sangat kecil, dT, maka perubahan entalpi zat tersebut adalah Cp dT. Oleh karena itu, untuk perubahan temperatur dari T1 ke T2, entalpi zat berubah dari H(T1) menjadi :

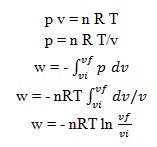
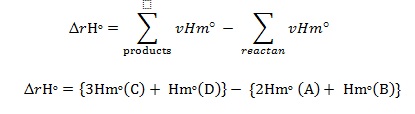


Post Comment