Materi Pelajaran
asam asetat, atm, Bayer, Business, cairan, Cell, Cell membrane, darah, derajat ionisasi, differentially permeable membrane, faktor vant hoff, glukosa, infus, isotonik, Macular degeneration, Osmotic pressure, pembahasan kimia, perumpamaan, Regeneron, soal dan pembahasan, soal kimia, tanya jawab, Tekanan, tekanan osmosis, tekanan osmotik, tetapan gas, United States, vant hoff
Krisna Dwi Wardhana
19 Comments
Soal dan Pembahasan Tekanan Osmotik
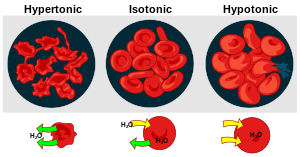
Berikut ialah beberapa soal mengenai tekanan osmotik yang ditanyakan oleh para pembaca. Disini akan dilakukan pembahasan mengenai soal tersebut karena pada tanya jawab hanya di berikan tips dan petunjuk mengerjakan soal.
1. Berapa gr urea CO(NH2)2 yg terlrut dlm 200mL larutan agar isotonik dengan 18 gr glukosa, C2H12O6 yg terlarut dlm 500mL pd keadaan yg sama? (Ar C=12, O=16, N=14, H=1).
Jawab:
isotonik menyatakan kondisi dimana terjadi kesamaan tekanan osmotik jadi π1=π2
anggap π1 untuk larutan glukosa dan π2 untuk larutan urea. diketahui rumus tekanan osmotik yaitu :
π=MRTi namun karena urea dan glukosa bukan elektrolit maka i=1
π1=π2 ——-> M1RT = M2RT ( T dan R dianggap sama)
M1 = M2 ——> (18gr/132)/0,5 L = (xgr/60)/0,2 L ——–> x = 3,27 gr
2. Tekanan osmotik rata2 dr darah adalah 7,7 atm 25 derjt C. Berapakah konsentrasi glukosa (C6 H12 O6) akan isotonik (tekanan sama) dgn darah?
Jawab :
Hampir sama seperti pertanyaan no.1
pertama tama kita beri perumpamaan dahulu π1 = tekanan larutan glukosa π2= tekanan darah
π1=π2
MRT = 7,7 atm
xM . (0,082 L atm mol–1K–1) . 298 K = 7,7 atm
x = 0,31 M
3. Seorang pasien memerlukan
larutan infus glukosa. Bila kemolaran cairan tsb 0,3 molar pada suhu tubuh 37 derajat C, tentukan tekanan osmotiknya! (R=0,082 L atm mol-1K-1)
Jawab :
π = MRT
π = 0,3 mol/L . (0,082 L atm mol–1K–1) . 310K
π = 7,62 atm
- larutan glukosa 2 M isotonik dengan larutan CH3COOH 1,5 M. Derajat ionisasi larutan asam asetat tersebut adalah ??(Kb=0,52¤C/m)
Jawab :
asam asetat termasuk elektrolit lemah sehingga rumusnya π = MRTi dimana i=(1+(n-1)α)
umpamakan π1 = tekanan os. glukosa dan π2 = tekanan os. asam asetat
π1 = π2
M1RT = M2RTi ——————– R dan T bisa dihilangkan
2 = 1,5 . (1+(n-1)α) ——— n = 2 ( merupakan jumlah ion dari ionisasi asam asetat = CH3COO- dan H+
2 = 1,5 . (1+1α) ——> 2 = 1,5 + 1,5α
α = 3
demikian pembahasan dari beberapa soal tentang tekanan osmotik yang di tanyakan oleh pembaca. Silahkan komentar jka ada koreksi atau pertanyaan.
Latest posts by Krisna Dwi Wardhana (see all)
- Kunci jawaban IPAS kelas 4 halaman 158: Menjelajahi keragaman budaya - February 20, 2026
- Pengakuan Terbesar Saya Tentang Tinggal Bersama Bipolar — dan Apa Yang Mereka Ajarkan Saya - February 20, 2026
- 30 Contoh Teks Eksplanasi Fenomena Alam Lengkap dengan Makna, Struktur, dan Ciri-Cirinya - February 20, 2026



19 comments