Rangkuman Elektrokimia Singkat
Reaksi Reduksi Oksidasi
Reaksi yang melibatkan terjadinya transfer elektron diikuti dengan
perubahan bilangan oksidasi pada senyawa atau unsur yang terlibat
• Oksidasi adalah peristiwa hilangnya elektron dari suatu spesies yang menyebabkan naiknya bilangan oksidasi spesies tersebut
• Reduksi adalah peristiwa penambahan elektron pada suatu spesies yang menyebabkan turunnya bilangan oksidasi spesies tersebut
• Agen pengoksidasi adalah reaktan yang mengalami reduksi
• Agen pereduksi adalah reaktan yang mengalami oksidasi
Terminologi Redoks
Reaksi Redoks dan Reaksi Non Redoks
Reaksi Redoks:
• Reaksi pembakaran (C x H y + O 2 → CO 2 + H 2 O)
• Reaksi penggabungan (A + B → C)
• Reaksi dekomposisi (AB → A+ B)
Reaksi non redoks:
• Jenis reaksi penggantian: (AB + CD → AD + CB)
• Reaksi pengendapan
• Reaksi asam basa
Menyelesaikan Reaksi Persamaan reaksi redoks
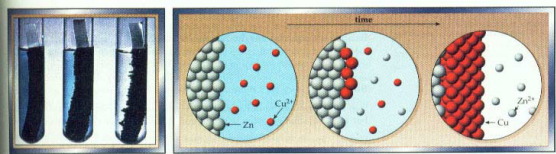
- Mengenali bahwa reaksi adalah proses oksidasi dan reduksi Bilangan oksidasi Zn naik dari 0 ke +2 dan Cu turun dari +2 menjadi 0. maka reaksi adalah reaksi oksidasi dan reduksi
- Memisahkan proses menjadi dua buah setengah reaksi
Oksidasi : Zn → Zn 2+
Reduksi : Cu 2+ → Cu - Menyeimbangkan massa kedua setengah reaksi
Oksidasi : Zn → Zn 2+
Reduksi : Cu 2+ → Cu
4. Menyeimbangkan muatan kedua setengah reaksi
Oksidasi : Zn → Zn 2+ + 2e
Reduksi : Cu 2+ + 2e → Cu
5. Mengalikan masing‐masing persamaan reaksi dengan faktor
yang sesuai
Oksidasi : Zn → Zn 2+ + 2e 1X
Reduksi : Cu 2+ + 2e→ Cu 1X
6. Menjumlahkan kedua setengah reaksi untuk menghasilkan
persamaan reaksi yang seimbang
Zn + Cu 2+ → Zn 2+ + Cu
7. Menghitung kembali kesetimbangan massa dan muatan
Menyelesaikan Persamaan Reaksi Redoks (dalam larutan asam)
Misal : VO 2 + (aq) + Zn (s) → VO 2+ (aq) + Zn 2+
1. Mengenali bahwa reaksi adalah proses oksidasi dan reduksi
Bilangan oksidasi Zn naik dari 0 ke +2 dan V turun dari +5 menjadi +3 maka reaksi adalah reaksi oksidasi dan reduksi
- Memisahkan proses menjadi dua buah setengah reaksi
Oksidasi : Zn → Zn 2+Reduksi : VO 2+ → VO 2+ Menyeimbangkan massa kedua setengah reaksi
Oksidasi : Zn → Zn 2+
Reduksi : VO 2+ → VO 2+
Pada larutan asam, H 2 O ditambahkan pada sisi yang kekurangan
oksigen
VO 2+ + 2H + → VO 2+ + H 2 OMenyeimbangkan muatan kedua setengah reaksi
Oksidasi : Zn → Zn 2+ + 2e
Reduksi : VO 2+ + 2H + + e →VO 2+ + H 2 OMengalikan masing‐masing persamaan reaksi dengan faktor yang
sesuai agar jumlah elektron sama
Oksidasi : Zn →Zn 2+ + 2e 1X
Reduksi : VO 2+ + 2H + + e→VO 2+ + H 2 O 2XMenjumlahkan kedua setengah reaksi untuk menghasilkan persamaan reaksi yang seimbang
Zn + 2 VO 2+ + 4H + →2 VO 2+ + 2 H 2 O + Zn 2+
7. Menghitung kembali kesetimbangan massa dan muatan
Menyelesaikan Persamaan Reaksi Redoks (dalam larutan basa)
Misal : MnO 4‐ (aq) + HO 2- (aq) → MnO 42- (aq) + O 2 (g)
1. Mengenali bahwa reaksi adalah proses oksidasi dan reduksi
Bilangan oksidasi O naik dari ‐1 ke 0 dan Mn turun dari +7 menjadi +6 maka reaksi adalah reaksi oksidasi dan reduksi
- Memisahkan proses menjadi dua buah setengah reaksi
Oksidasi : HO 2- →O 2
Reduksi : MnO 4‐ → MnO 4 2-
Menyeimbangkan massa kedua setengah reaksi
Oksidasi : HO 2- →O 2
Reduksi : MnO 4‐ → MnO 42-
Pada larutan basa, OH ‐ ditambahkan pada sisi yang kelebihan oksigen
HO 2- + OH – →O 2 + H 2 O + 2e
4. Menyeimbangkan muatan kedua setengah reaksi
Oksidasi : HO 2- + OH ‐ → O 2 + H 2 O + 2e
Reduksi : MnO 4– + e → MnO 42-
- Mengalikan masing‐masing persamaan reaksi dengan faktor yang
sesuai agar jumlah elektron sama
Oksidasi : HO 2- + OH ‐ → O 2 + H 2 O + 2e 1X
Reduksi : MnO 4‐ + e → MnO 42- 2X
Menjumlahkan kedua setengah reaksi untuk menghasilkan persamaan
reaksi yang seimbang
HO 2- + OH – + 2 MnO 4– → O 2 + H 2 O + 2 MnO 42-
7. Menghitung kembali kesetimbangan massa dan muatan
Bahasan Sel Elektrokimia dan lainnya silahkan melanjutkan ke halaman selanjutnya
- FK Unusa Kolaborasi dengan Universiti Sains Malaysia, Tingkatkan IPM Melalui Program Fellowship - February 21, 2026
- Bumbu - February 21, 2026
- 1.708 Mahasiswa Dilantik, Rektor UPGRIS: Ormawa Jadi Laboratorium Kehidupan - February 21, 2026




4 comments