Materi Pelajaran
a--> b, Ada, Asia, Business, Catalysis, Chemical reaction, Cho Kyuhyun, Earth Science, Enzyme, Government, Indonesia, Karena, Kata, kecepatan reaksi kimia, kinetiak kimia, kinetika kimia, Kita, LAJU REAKSI, Languages, menghitung laju reaksi, pH, Programming, Reaction rate, reaksi kimia, Salah, soal dan pembahasan, soal pembahasan laju reaksi, Temperature, United States
krisnadwi
3 Comments
Kinetika Kimia : Laju Reaksi
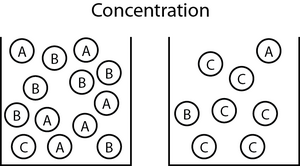
Kinetika kimia merupakan salah satu bidang dalam kimia yang mempelajari tentang kecepatan dan laju terjadinya reaksi kimia. Kata “kinetik” bermaksud perubahan atau perubahan. Salah satu hal penting yang perlu di pelajari dalam kinetika kimia ini adalah laju reaksi. Laju reaksi ialah perubahan konsentrasi reaktan atau produk terhadap waktu(M/s).
Kita telah tahu bahwa setiap reaksi dapat dinyatakan dengan persamaan umum
Reaktan——->Produk atau A—>B
Persamaan ini memberitahukan bahwa, selama berlangsungnya suatu reaksi, molekul reaktan bereaksi sedangkan molekul produk terbentuk. Sebagai hasilnya, kita dapat kita dapat mengamati jalannya reaksi dengan cara memantau menurunnya konsentrasi reaktan atau meningkatnya konsentrasi produk.
Grafik perbandingan konsentrasi reaktan dan produk dapat kita lihat pada gambar di bawah

Secara umum akan lebih mudah apabila kita menyatakan laju dalam perubahan konsentrasi terhadap waktu. Jadi, untuk reaksi diatas kita dapat menyatakan laju reaksi sebagai
laju = -(Δ[A] / Δt) atau laju = -(Δ[B] / Δt)
dengan Δ[A] dan Δ[B] adalah perubahan konsentrasi (M) selama waktu t. Karena konsentrasi A menurun selama selang waktu tersebut, Δ[A] merupakan kuantitas negatif karena terus berkurang. Laju reaksi ialah kuantitas positif, oleh karena itu diperlukan tanda negatif, sebaliknya Δ[B] akan terus bertambah maka tidak perlu ditambah tanda negatif.
Untuk reaksi yang lebih rumit, kita harus hati hati dalam menuliskan rumus laju. Misalnya pada persamaan reaksi : 2A—->B
Dalam reaksi tersebut, 2 mol A menghilang setiap terbentuk 1 mol B. Dalam kasus seperti ini kita harus menuliskan lajunya sebagai
laju = -(1/2)(Δ[A] / Δt) atau laju = -(Δ[B] / Δt)
dan untuk reaksi aA + bB —> cC + dD mak lajunya
Laju =-(1/a)(Δ[A] / Δt)= -(1/b)(Δ[B] / Δt) = (1/c)(Δ[C] / Δt) = (1/d)(Δ[B] / Δt)
CONTOH SOAL:
Tulis rumus laju untuk reaksi berikut ini ditinjau dari hilangnya reaktan dan munculnya produk:
1. I- + OCl- ——> Cl- + OI
2. 3O2 —> 2O3
PEMBAHASAN :
1.karena semua koefisiennya 1 maka
Laju =-(Δ[I-] / Δt)= -(Δ[OCl- ] / Δt) = (Δ[Cl-] / Δt) = (Δ[OI] / Δt)
2. ada beberapa koefisien yang berbeda maka
Laju =-(1/3) (Δ[O2] / Δt) = (1/2) (Δ[O3] / Δt)

3 comments