Materi Pelajaran
Activated carbon, adsorpsi, Adsorption, Aluminium oxide, Asia, Chemistry, Dan, fisisorpsi, Hari, Indonesia, Kali, katalis, Katalis Heterogen, kemisorpsi, Lama, Oil spill, Oxford University Press, Physical Chemistry, Sangat (term), Tak Province, zeolit, Zinc oxide
krisnadwi
3 Comments
Pendahuluan Katalis Heterogen
ADSORPSI

- Adsorpsi Kimia (Kemisorpsi)
Adsorpsi ini bersifat spesifik dan terjadi karena adanya ikatan kimia antara adsorben dengan zat yang teradsorpsi (adsorbat). Pada adsorpsi kimia hanya satu lapisan(monolayer)yang terjadi dan biasanya terjadi pada suhu tinggi. Besarnya energi adsorpsi kimia ±100 kj/mol. Adsorpsi jenis ini menyebabkan terbentuknya ikatan secara kimia sehingga diikuti dengan reaksi kimia, maka adsorpsi jenis ini akan menghasilkan produksi reaksi berupa senyawa yang baru. Ikatan kimia yang terjadi pada kemisorpsi sangat kuat mengikat molekul gas atau cairan dengan permukaan padatan sehingga sangat sulit untuk dilepaskan kembali (irreversibel). Dengan demikian dapat diartikan bahwa pelepasan kembali molekul yang terikat di adsorben pada kemisorpsi sangat kecil (Alberty, 1997).
- b. Adsorpsi Fisika (Fisisorpsi)
Adsorpsi ini tidak spesifik dan terjadi akibat adanya perbedaan energi atau gaya tarik bermuatan listrik (gaya Van Der Waals).Pada jenis adsorpsi fisika ini, terjadi beberapa lapisan (multilayer) dan terjadi pada suhu rendah.Besarnya energi adsorpsi fisika ±10 kj/mol. Molekul-molekul yang di adsorpsi secara fisika tidak terikat kuat pada permukaan, dan biasanya terjadi proses balik yang cepat (reversibel), sehingga mudah untukdigantidenganmolekul yang lain. Adsorpsi fisika didasarkan pada gaya Van Der Waals, dandapatterjadipadapermukaan yang polar dan non polar. Adsorpsi juga mungkin terjadi dengan mekanisme pertukaran ion. Permukaan padatan dapat mengadsorpsi ion-ion dari larutan dengan mekanisme pertukaran ion. Oleh karena itu, ion pada gugus senyawa permukaan padatan adsorbennya dapat bertukar tempat dengan ion-ion adsorbat. Mekanisme pertukaran ini merupakan penggabungan dari mekanisme kemisorpsi dan fisisorpsi, karena adsorpsi jenis ini akan mengikat ion-ion yang diadsorpsi dengan ikatan secara kimia, tetapi ikatan ini mudah dilepaskan kembali untuk dapat terjadinya pertukaran ion (Atkins, 1990).
KATALIS HETEROGEN
Katalis heterogen adalah katalis yang fasenya berbeda dengan fase zat yang bereaksi maupun zat hasil reaksi.
Contoh sederhana katalisis heterogen adalah katalis menyediakan suatu permukaan dimana pereaksi-pereaksi (atau substrat) untuk sementara terjerap. Ikatan dalam substrat-substrat menjadi lemah sehingga memadai terbentuknya produk baru. Ikatan antara produk baru dan katalis lebih lemah sehingga akhirnya terlepas
Mekanisme katalisis heterogen :
1. Difusi molekul-molekul pereaksi menuju permukaan
2. Adsorpsi molekul-molekul pereaksi pada permukaan
3. Reaksi pada permukaan
4. Desorpsi hasil dari permukaan
5. Difusi hasil dari permukaan menuju badan sistem
a. Katalis Pendukung
Katalis heterogen biasanya membutuhkan pendukung (support), karena pendukung katalis memiliki kekuatan mekanik, tahan panas, mempunyai kerapatan ruah yang optimal, dan kemampuan pelarutan fase aktif. Pendukung juga meningkatkan luas permukaan, memiliki pori serta ukuran partikel yang optimal, dan peningkatan fungsi kimiawi seperti perbaikan aktivitas. Pemilihan pendukung didasarkan pada beberapa hal :
· Keinertan
· Sifat mekanik yang diinginkan, termasuk ketahanan terhadap kikisan, kekerasan dan ketahanan terhadap tekanan.
· Kestabilan pada kondisi reaksi dan regenerasi.
· Luas permukaan, diutamakan yang memiliki luas permukaan besar agar semakin banyak sisi aktif katalis yang terdistribusi.
· Porositas, meliputi ukuran pori rata-rata dan distribusi ukuran pori
· Sifat ekonomis bahan.
Padatan pendukung juga memiliki beberapa fungsi lain, yaitu untuk mendispersikan sisi aktif, menstabilkan pendispersian serta memberikan kekuatan mekan
| Reaksi | Katalis |
| C4H10 –> Butena dan C4H6 | Cr2O3-Al2O3 |
| CH4 atau hidronium lain + H2O –> CO + H2 | Ni Support |
| C2H2 + 2H2 –> C2H6 | Pd dalam Al2O3 atau padatan pendukung Ni-Sulfida |
| Hidro Cracking | Logam (seperti Pd) pada Zeolit |
| CO + 2H2 –> CH3OH | Cu-ZnO dengan Cr2O3 atau Al2O3 |
Contoh
Contoh reaksi dari C2H2 + 2H2 –> C2H6 dengan menggunakan katalis heterogen Pd/Al2O3 telihat secara sederhana pada gambar
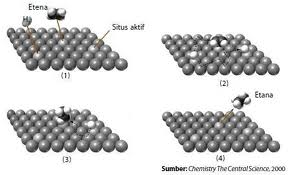
Sumber
alberty r. a. and r. j. silbey (1997). physical chemistry. new york wiley
Atkins, P.W., (1990), Physical Chemistry, Oxford University Press, Oxford.

3 comments