Ringkasan Materi Sistem Periodik Unsur – Part 2
Lanjutan dari Ringkasan Materi Sistem Periodik Unsur bagian 1
Sistem Periodik Triade Dobreiner
Dasar Pengelompokan
-
Menurut kemiripan sifat
-
Menurut kenaikan massa atomnya ke dalam satu triade yang terdiri dari 3 unsur
-
Massa atom maupun sifat-sifat unsur yang kedua merupakan rata-rata dari massa atom/sifat2 unsur pertama dan ketiga
Contoh :
|
Triade |
Ar |
Rata2 Ar unsur |
Wujud |
| Klorin
Bromin Iodin |
35,5
79,9 127 |
35,5+127/2
= 81,25 |
Gas
Cair Padat |
Kelemahan :
Kurang efisien, karena ternyata ada beberapa unsur lain yang tidak termasuk dalam satu triade, tetapi mempunyai sifat2 mirip dengan triade tsb.
Sistem Periodik Oktaf Newlands
-
Berdasarkan kenaikan Ar
-
Unsur yang berselisih 1 oktaf (unsur nomor 1 dgn nomor 8, nomor 2 dengan nomor 9, dst) menunjukkan kemiripan sifat
Contoh :
|
So 1 |
Re 2 |
Mi 3 |
Fa 4 |
Sol 5 |
La 6 |
Si 7 |
|
H |
Li |
Be |
B |
C |
N |
O |
|
F |
Na |
Mg |
Al |
Si |
P |
S |
|
Cl |
K |
Ca |
Cr |
Ti |
Mn |
Fe |
|
Co, Ni |
Cu |
Zn |
Y |
In |
As |
Se |
Kelemahan :
Hanya berlaku untuk unsur-unsur ringan (Ar rendah)
Sistem Periodik Bentuk Pendek : Mendeleyev
Dasar Pengelompokan
-
Menyusun unsur-unsur berdasarkan kenaikan Ar dan persamaan sifat
-
Menyatakan bahwa sifat-sifat unsur adalah fungsi periodik dari massa atom relatifnya
-
Terdiri atas 63 unsur
Contoh :
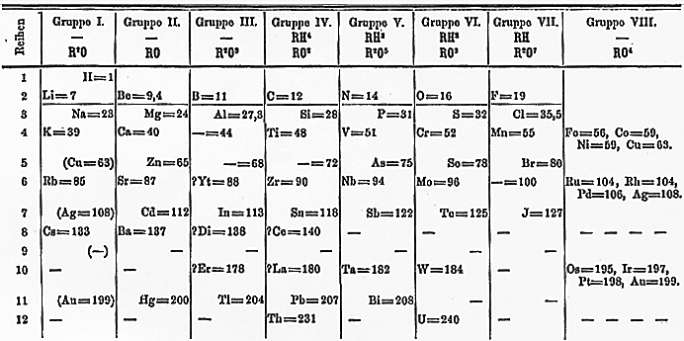
Kelemahan :
Penempatan beberapa unsur tidak sesuai dengan kenaikan Ar. Selain itu, masih banyak unsur yang belum dikenal
Keunggulan :
Berani mengosongkan beberapa tempat keyakinan bahwa masih ada unsur yang belum dikenal
Sistem Periodik Modern (Bentuk Panjang): Moseley
Dasar Pengelompokan
-
Penyempurnaan dari sistem periodik Mendeleyev
-
Menyusun sistem periodik berdasarkan kenaikan nomor atom dan kemiripan sifat
-
Menyatakan bahwa sifat-sifat unsur adalah fungsi periodik dari nomor atomnya
-
Lantanida dan aktinida ditemukan oleh Glenn Seaborg, 1940
Sama dengan SPU yang kita gunakan saat ini


Post Comment