Hukum Kedua Temodinamika : Konsep Konsep
-Entropi
Hukum kedua termodinamika lebih dinyatakan dalam fungsi keadaan lain,yakni entropi (S),entropi pada hukum kedua diperbolehkan untuk mengenali perubahan spontan .
Hukum kedua :Entropi suatu sistem yang terisolasi bertambah selama ada perubahan spontan dengan rumus : ∆Stot >0
-Definisi statis entropi
Definisi statis entropi dirumuskan : S = k ln W
Dengan k sebagai tetapan boltzman dengan nilai k=1,318 x 10^23 J /K,dan W adalah banyaknya jalan agar energi sistem adalah penyusunan atom –atom dalam keadaan yang ada.
-Definisi termodinamika dari entropi
Dalam perumusan entropi dalam lingkungan dS’digambarkkan dengan resevoir termal yang besar dengan temperatur tetap T.Andaikan ,beban yang dijatuhkan dihubungkan dengan resevoir dan ketika beban turun,sejumlah kalor dq’ dipindahkan ke resevoir.Makin besar pula gerakan termal yang ditimbulkan,maka dapat dirumuskan dS’~dq’ ,karena kualitas energi turun lebih jauh jika energi itu dipindahkan ke resevoir dingin ketimbang resevoir panas ,maka dapat dirumuskan
dS’=dq’/T’ dalam hal perubahan adiabatik dirumuskan ∆S’ = 0 jika q’ = 0
Jika reaksi kimia berlangsung dalam sistem dengan perubahan entalpi ∆H,kalor yang memasuki lingkungan pada tekanan tetap adalah q’ = -∆H,sehingga perumusannya menjadi: ∆S’=-ΔH/T’
-Perubahan entropi sistem
Untuk menghitung entropi sistem kita mengambil strategi dengan menggunakkan lingkungan untuk mengembalikan sistem ke keadaan awalnya,oleh karena itu temperatur lingkungan sama dengan temperatur sistem atau bisa dirumuskan T’=T.Dalam keadaan reversibel entropi mengalami perubahan sebesar –dS dan energinya pun berubah sebesar – dqrev .Energi ini berasal dari lingkungan, maka lingkungan mengalami perubahan energi dq’= -dqrev dan entropinya berubah sebesar dS’ = dqrev/T .Walaupun demikian,perubahan entropi total sistem global ,terisolasi selama pemulihan bernilai nol .Oleh karena itu: -dS+ dqrev/T=0 atau dqrev/T=dS. Untuk perubahan yang dapat diukur,perubahan entropi adalah jumlah dari perubahan – perubahan sangat kecil
-Perubahan entropi tak-reversibel
Jika pada suatu sistem dalam kontak termal dan kontak mekanis dengan lingkungannya,maka semua perubahan keadaan disertai dengan perubahan entropi sistem dS dan perubahan entropi lingkungannya dS’.Secara umum ,perubahnan entropi keseluruhan bernilai lebih dari nol,karena prosesnya mungkin tak reversibel :
dS + dS’ ≥ 0 atau dS ≥ -dS’,karena dS’ = -dq/T,maka dS≥dq/T,ketaksaman ini disebut ketaksamaan Clausius, lalu kita akan membahas tentang 2 pertambahan entropi,yakni : pemuaian bebas gas dan pendinginan benda panas.
Pemuaian spontan
Mula –mula kita misalkan sistem mengalami perubahan adiabatik tak-reversibel .Maka dq=0 dan dengan ketaksamaan Clausius dS > 0.
Pada keadaan tak reversibel dq = -dw,karena gas memuai bebas keruang hampa,gas tidak melakukan kerja ;sehingga dw =0,yang berarti dq =0,oleh karena itu dS>0.
Untuk entropi dalam lingkungan dirumuskan dengan dS’=0 ,dari entropi dalam sistem dan lingkungan dapat kita simpulkan bahwa: dStot>0
Dengan demikian,proses-proses itu spontan.
Pendinginan spontan
Bayangkan pemindahan energi sebagai kalor dari satu resevoir besar sumber pada temperatur tinggi Th ke resevoir lain wadah yang suhunya lebih rendah Tc ,maka dapat dirumuskan
Pada proses pendinginan ini bersifat spontan.
-Perubahan entropi yang menyertai proses-proses khusus
Entropi transisi fasa temperatur transisi
Pada tekanan tetap disimpulkan qrev =Δ Htrs ,maka ∆S=Δ Htrs/Tt ,dalam transisi eksoterm perubahan entropi bernilai negatif ,jika transisinya endoterm ,perubahan entropinya bernilai positif
Pemuaian gas sempurna
Pada pemuaian gas sempurna terjadi perubahan entropi gas sempurna yang memuai secara isotermal dari Vi ke Vf dan dirumuskan dengan ∆S = nR ln (Vf/Vi) , bentuk ini berlaku baik dalam keadaan reversibel maupun tak-reversibel,maka perubahan entropi lingkungan adalah
∆S’ = -nR ln (Vf/Vi)
karna tak ada kerja yang dilakukan dan jika temperatur tetap ,maka tak ada kalor yang dipindahkan antar sistem dan lingkungannya . Jadi perubahan entropi keseluruhan dari sistem global terisolasi adalah
ΔStot= nR ln (Vf/Vi)
Perubahan entropi jika sistem dipanaskan
Dari persamaan entropi sebelumnya S()=S()+ ,jika perubahan entropi dalam tekanan tetap maka dqrev= Cp dT, lalu kita dapat merumuskan demikian juga pada volume tetap
Pengukuran Entropi
Entropi sistem pada temperaturT dapat dihubungkan dengan entropi pada T = 0 dengan mengukur kapasitas kalor pada temperatur berbeda –beda ,maka pada setiap transisi dirumuskan
Salah satu masalah dalam pengukuran entropi adalah sukarnya mengukur kapasitas kalor di dekat T=0.Ada dasar –dasar teori yang menganggap kapasitas kalor sebanding dengan jika T rendah ,dan ini merupakan dasar dari ekstrapolasi Debye,dalam metode ini diukur sampai temperatur serendah mungkin.

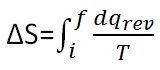
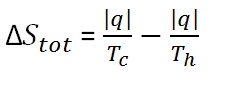
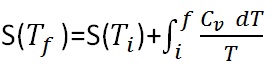

Post Comment