Rangkuman Energetika Lengkap
ENERGETIKA
I. ASAS KEKEKALAN ENERGI
 Energi tidak dapat diciptakan atau dimusnahkan. Setiap reaksi kimia selalu disertai oleh pembuatan energi. Bagian ilmu kimia yang mempelajari perubahan energi panas yang menyertai reaksi kimia disebut Termokimia.
Energi tidak dapat diciptakan atau dimusnahkan. Setiap reaksi kimia selalu disertai oleh pembuatan energi. Bagian ilmu kimia yang mempelajari perubahan energi panas yang menyertai reaksi kimia disebut Termokimia.
Beberapa Pengertian
- Kalor Reaksi : Energi yang berpindah dari sistem ke lingkungan atau sebaliknya.
- Reaksi Eksoterm : Reaksi yang membebaskan energi panas (energi berpindah dari sistem ke lingkungan)
- Reaksi Endoterm : Reaksi yang menyerap energi panas (energi berpindah dari lingkungan ke sistem)
II. TERMOKIMIA
 Kalor reaksi atau panas reaksi dibedakan menjadi :
Kalor reaksi atau panas reaksi dibedakan menjadi :
a. Panas Pembentukan : panas reaksi yang menyertai pada pembentukan 1 mol suatu senyawa langsung dari unsur-unsurnya.
Contoh:
C (S) + O 2 ( g ) → CO 2 (g) , ΔH = 393,52 kj
H 2(g) + ½ O 2 (g) → H 2 O (g) , ΔH = -241,82 kj
b. Panas Peruraian : panas reaksi yang menyertai peruraian 1 mol suatu senyawa menjadi unsur-unsurnya.
Contoh:
H 2 O (g) → H 2(g) + ½ O 2(g) , ΔH = +241,82 kj
ΔH peruraian = – ΔH pembentukan
c. Panas pembakaran : panas reaksi pada pembakaran 1 mol zat.
Contoh :
C 2 H 2 (g) + 3 O 2 (g) → 2 CO 2(g) + 2H 2 O, ΔH = -1,4441 kj
d. Panas Pelarutan : banyaknya panas yang timbul pada pelarutan 1 mol zat dalam pelarutan yang jumlahnya sedemikian banyak, sehingga penambahan pelarut tidak menyebabkan timbulnya efek panas dan dapat diukur.
Contoh :
HCI (g) + aqua → HCl (aq) : ΔH = -4,32 kj
e. Panas Netralisasi : panas yang dibebaskan di dalam reaksi antara ion H+ dan ion Contoh :
H+ (aq) + OH- (aq) → H 2 O (aq) : ΔH = -56,83 kj
Pengukuran perubahan Entalphi ( DH)
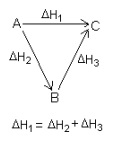
Secara eksperimen ΔH ditentukan dengan menggunakan kalorimeter. Perubahan etalphi (ΔH) suatu reaksi hanya bergantung keadaan awal (pereaksi) dan keadaan akhir (hasil reaksi) dan tidak tergantung pada jalannya reaksi, (Hukum Hess).
Contoh :
ΔH reaksi = ΔH hasil reaksi – ΔH pereaksi
Untuk melanjutkan ke energi ikatan dan arah prosesnya silahkan ke halaman 2


Post Comment