Ringkasan Materi Persamaan Reaksi
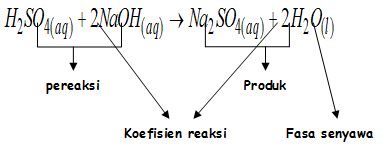
Persamaan reaksi menggambarkan reaksi kimia yang terdiri dari atas rumus kimia pereaksi dan hasil reaksi disertai koefisiennya.
Hukum Kekekalan Massa
Hukum ini dinyatakan oleh Lavoisier , yaitu : bahwa massa zat-zat sebelum harus sama dengan massa zat-zat sesudah reaksi. Oleh karena massa zat ditentukan oleh jumlah atom, maka jumlah atom dari setiap unsur di ruas kiri harus sama dengan di ruas kanan.
Penyetaraan Reaksi
Beberapa langkah penting yang harus diperhatikan dalam menyetarakan persamaan reaksi adalah :
-
Tulis rumus kimia dari pereaksi dan produk reaksi. Sertakan wujud/ keadaan zat jika diketahui
-
Beri koefisien reaksi agar jumlah atom dari setiap unsur di ruas kiri sama dengan di ruas kanan
-
Pilih zat dengan rumus kimia paling kompleks. Tetapkan harga koefisien reaksinya dengan 1. Beri koefisien sementara untuk zat-zat lainnya dengan huruf a, b, c, dst.
-
Setarakan atom-atom pada zat yang paling kompleks. Jika terdapat ion poliatom di ruas kiri dan kanan serta tidak berubah, maka setarakan sebagai ion poliatom bukan sebagai atom.
-
Setarakan atom-atom lainnya. Jika terdapat ion poliatom di ruas kiri dan kanan serta tidak berubah, maka setarakan sebagai ion poliatom, bukan sebagai atom.
-
Pastikan setiap koefisien reaksi merupakan bilangan bulat sederhana (koefisien 1 tidak disertakan dalam persamaan reaksi).
-
Dengan mengacu kepada hukum Lavoisier diatas, maka jumlah atom di kiri dan di kanan harus disamakan melalui penyetaraan koefisien reaksi.
Contoh :
KMnO4 + H2SO4 + FeSO4 K2SO4 + MnSO4 + Fe2(SO4)3 + H2O
Pertama, Pilih zat dengan rumus kimia paling kompleks, Fe2(SO4)3. Koefisien sementara untuk zat-zat lainnya diberi huruf a, b,c , dst.
aKMnO4 + bH2SO4 + cFeSO4 dK2SO4 + eMnSO4 + 1 Fe2(SO4)3 + eH2O
Kedua, Setarakan atom-atom pada zat yang paling kompleks. Jika terdapat ion poliatom di ruas kiri dan kanan serta tidak berubah, maka setarakan sebagai ion poliatom bukan sebagai atom
-
Jumlah di ruas kiri
=
Jumlah di ruas kanan
Hasil
Atom Fe
2
=
c
c = 2
Atom SO42-
b + c
=
3 + d + e
3 + d + e – 2 = b
1 + d + e = b
Ketiga, Setarakan atom-atom pada zat-zat lainnya. Jika terdapat ion poliatom di ruas kiri dan kanan serta tidak berubah, maka setarakan sebagai ion poliatom. Atom lainnya yang belum disetarakan adalah H dan O.
-
Jumlah di ruas kiri
=
Jumlah di ruas kanan
Hasil
Atom K
a
=
2d
a = 2d; d = ½ a
Atom Mn
a
=
e
a = e
1 + d + e = b
1 + ½ a + a = b
1 + 3/2 a = b
1 + 3d = b
Atom H
2b
=
2f
b = f
Atom O
4a
=
f
a = ¼ f; 4a = f
Persamaan atom Mn :
1 + 3d = b
1 + 3 (1/2 a) = 4a
a = 2/5
Persamaan atom Mn : a = e = 2/5
Persamaan atom Mn :
b = 1 + 3(1/5)
b = 8/5
Persamaan atom K :
d = ½ (2/5) = 1/5 f = 8/5
2/5 KMnO4 + 8/5 H2SO4 + 2 FeSO4 1/5 K2SO4 + 2/5 MnSO4 + 1 Fe2(SO4)3 + 8/5H2O
Keempat, Pastikan setiap koefisien reaksi merupakan bilangan bulat sederhana (koefisien 1 tidak disertakan dalam persamaan reaksi.
2/5 KMnO4 + 8/5 H2SO4 + 2 FeSO4 1/5 K2SO4 + 2/5 MnSO4 + 1 Fe2(SO4)3 + 8/5H2O
====================================================== x 5
sehingga persamaan reaksinya menjadi :
2 KMnO4 + 8 H2SO4 + 10 FeSO4 K2SO4 + 2MnSO4 + 5 Fe2(SO4)3 + 8H2O

Post Comment