Rangkuman Elektrokimia Singkat
Sel Elektrokimia
Ada 2 jenis sel elektrokimia
1. Sel Elektrolisis adalah sel yang membutuhkan suatu sumber arus listrik luar untuk menyebabkan reaksi non spontan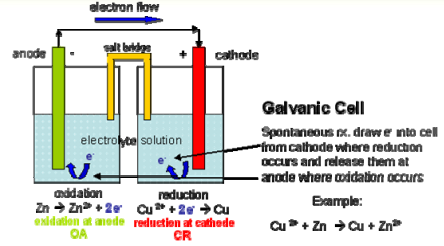
2. Sel Volta/Sel Galvanis adalah sel elektrokimia dimana suatu reaksi kimia spontan dapat menghasilkan energi listrik untuk digunakan pada suatu sirkuit luar.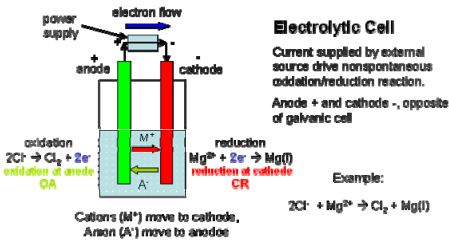
Arus listrik masuk dan keluar dari sel elektrokimia melalui elektroda. Reaksi-reaksi reduksi dan oksidasi terjadi pada permukaan elektroda.
Elektroda inert bila elektroda tidak ikut bereaksi
Ada 2 jenis elektroda:
- Katoda tempat reaksi reduksi terjadi
Anoda tempat reaksi oksidasi terjadi
Perubahan Kimia yang Menghasilkan Aliran Listrik
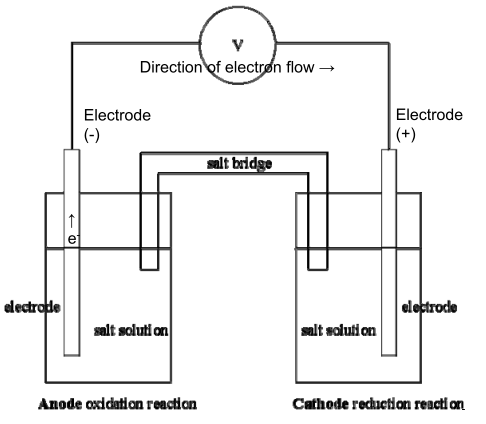
- Kedua sel terpisah sehingga transfer elektron terjadi melalui
suatu sirkuit luar - Masing‐masing setengah sel mengandung suatu spesies yang
tereduksi dan teroksidasi yang memiliki kontak satu sama lain - Kedua setengah sel tersebut dihubungkan dengan suatu jembatan garam
Elektrolisis : Perubahan Kimia Karena Adanya Energi Listrik
Anoda, oksidasi: 2 Cl – → Cl 2 (g) + 2e
Katoda, reduksi : 2Na + + 2e → 2 Na(l)
2 Cl– + 2 Na + → 2 Na (l) + Cl 2 (g) E net = ‐4V
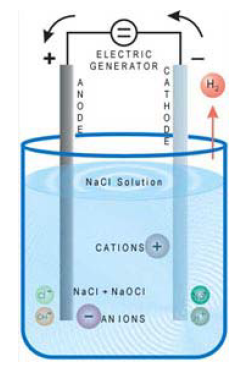
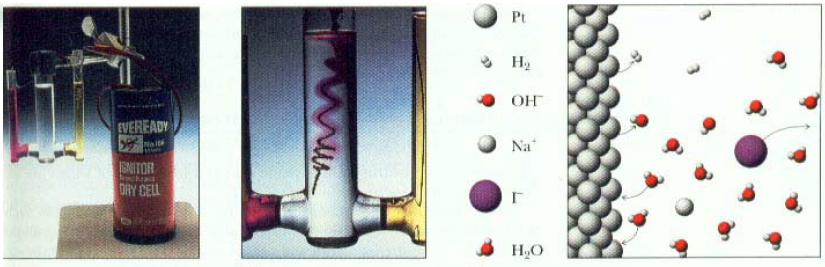
Anoda, oksidasi : 2I – (aq)→ I 2 (s) + 2e E o = ‐0.535 V
Katoda, reduksi :2H 2 O (l) + 2e → H 2 (g) + 2OH – (aq)
E o = ‐0.83 V
2I – (aq) + 2H 2 O (l) → I 2 (s) + H 2 (g) + 2OH – (aq)
E o net = ‐1.37 V
Menghitung Elektron
Kuat Arus, I ( A)=muatan listrik (C)/time ( s)
Time (s) x kuat arus (A) = muatan (C) → mol e → mol reaktan yang terlibat
Materi Potensial Elektrokimia beserta penjelasannya silahkan lanjut di halaman 3
- Sekolah di Tanahlaut Terdampak Banjir, Belajar dari Rumah Diizinkan - February 4, 2026
- RSUD AWS Samarinda Rekrut Tenaga Kontrak 2026, Lengkap dengan Formasi dan Jadwal - February 4, 2026
- What happens to cholesterol on the Mediterranean diet, say cardiologists - February 4, 2026



4 comments