Laporan Praktikum Instrumentasi : AES (Atomic Emission Spectroscopy)
TUJUAN
- Mengetahui dan memahami penggunaan instrumentasi AES
- Mengetahui dan memahami pengaruh masking agent dan releasing agent terhadap emisi suatu atom
TEORI DASAR
Spektroskopi serapan atom didasarkan pada adanya absorbsi radiasi gelombang elektromagnetik oleh atom-atom. Atom mempunyai dua keadaan tingkat energi, yaitu energi keadaan dasar (ground state) dan energi keadaan tereksitasi (excited state). Perbedaan tingkat energi dari keadaan dasar ke keadaan tereksitasi untuk setiap unsur adalah khas, sehingga panjang gelombang cahaya yang diabsorbsi oleh setiap unsur pun berbeda.
Spektroskopi atom digunakan untuk mengidentifikasi dan menentukan (kualitatif dan kuantitatif) logam-logam dalam tingkat ‘trace’ dalam semua jenis materi dan larutan. Dalam spektroskopi emisi, pengukuran berdasarkan energi yang diemisikan ketika atom-atom dalam keadaan tereksitasi untuk kembali ke keadaan dasar.
Atom yang dapat mengabsorbsi cahaya adalah atom-atom yang dalam keadaan bebas. yang dimaksud atom bebas disini adalah atom yang tidak bergabung dengan atom lain menjadi suatu molekul. Cara yang paling umum digunakan untuk mengatomisasi ialah dengan energi panas, panas pada temperatur yang tinggi dapat memutuskan ikatan antar atom sehingga terbentuk atom yang bebas.
Spektroskopi emisi atom (AES) adalah metode analisis kimia yang menggunakan intensitas cahaya yang dipancarkan dari api, plasma ,busur, atau percikan pada panjang gelombang tertentu untuk menentukan jumlah suatu unsur dalam sampel. Panjang gelombang dari garis spektral atom memberikan identitas elemen sedangkan intensitas cahaya yang dipancarkan sebanding dengan jumlah atom unsur.
AES menggunakan pengukuran kuantitatif dari optik emisi dari atom tereksitasi untuk menentukan konsentrasi analit. Atom analit dalam larutan yang disedot ke daerah eksitasi mana mereka desolvated, menguap, dan teratomisasi dengan api, debit, atau plasma. Suhu-tinggi atomisasi menyediakan sumber energi yang cukup untuk mempromosikan atom ke tingkat energi yang tinggi. Peluruhan atom kembali ke tingkat yang lebih rendah dengan memancarkan cahaya. Karena transisi antara tingkat energi atom yang berbeda, garis-garis emisi dalam spektrum yang sempit.
Spektrum sampel yang mengandung banyak unsur bisa sangat padat, dan pemisahan spektral atom transisi terdekat memerlukan resolusi tinggi spektrometer.
Instrumentasi untuk AES sebenarnya sama dengan AAS (Atomic Absorbance Spectroscopy), yang membedakan yaitu pada AAS yg di ukur adalah absorbansi nya sedangkan pada AES adalah emisinya. Sumber pengeksitasi atom suatu unsure diperlukan suatu sumber energy kalor yang mampu mengeksitasikan elektron di orbital paling luar dari atom tersebut ketingkat energi atom yang lebih tinggi. Pada spektrofotometri Emisi nyala, sumber pengeksitasinya adalah nyala api gas, tetapi kelemahan dari nyala api ini adalah energy kalor yang dihasilkan relative rendah. Misalnya campuran gas Acetilen dan O2 murni hanya akanmenghasilkan suhu sekitar 3000oC. Dengan kombinasi gas ini maka unsur-unsur yang dapat dieksitasikan dengan menghasilkan intensitas sinar emisi yang baik biasanya adalah logam-logam alkali (Na, K, Li, Cadll). Sedangkan untuk mengeksitasikan atom logam-logam yang lebih berat maka diperlukan nyala api dengan kombinasi gas lain yang dapat memberikan suhu lebih tinggi dan juga memberikan energy kalor yang lebih tinggi. Oleh karena itu AES cocok untuk menganalisis unsur- unsur logam golongan Alkali dan Alkali Tanah
Prinsip dasar dari analisa Atomic Emission Spectrometer (AES) ini yaitu : Apabila atom suatu unsur ditempatkan dalam suatu sumber energi kalor (sumber pengeksitasi), maka elektron di orbital paling luar atom tersebut yang tadinya dalam keadaan dasar atau ground state akan tereksitasi ke tingkat-tingkat energi elektron yang lebih tinggi. Karena keadaan tereksitasi itu merupakan keadaan yang sangat tidak setabil maka elektron yang tereksitasi itu secepatnya akan kembali ke tingkat energi semula yaitu kekeadaan dasarnya (ground state). Pada waktu atom yang tereksitasi itu kembali ketingkat energi lebih rendah yang semula, maka kelebihan energi yang dimilikinya sewaktu masih dalam keadaan tereksitasi akan dibuangkeluar berupa emisi sinar dengan panjang gelombang yang karakteristik bagi unsur yang bersangkutan khas. Intensitas Emisi tersebut juga sangat dipengaruhi oleh konsentrasi logam. Dari sini dapat dilakukan analisis kuantitatif.
Pada spektrometri nyala baik AAS maupun AES sering kali terjadi gangguan.Gangguan- gangguan tersebut antara lain:
- Gangguan Spektral.
Gangguan spektral terjadi bila panjang gelombang (atomic line) dari unsur yang diperiksa berimpit dengan panjang gelombang dari atom atau molekul lain yang terdapat dalam larutan yang diperiksa.
- Gangguan Kimia.
Reaksi-reaksi kimia yang terjadi dalam nyala (ionisasi, terbentuknya oksida, silikat, dan senyawa lainnya yang stabil ; reduksi dan sebagainya) dapat menimbulkan efek penurunan (depression, suspression) ataupun bahkan peningkatan (enchacement) dari adsorbans (A). Efek penurunan misalnya dijumpai dalam analisa Ca, Mg, Sr, dan sebagainya. Dalam contoh yang mengandung silikat, aluminat, fosfat dan sebagainya. Dimana diperoleh aborbans yang lebih rendah. Gangguan ionisasi juga termasuk gangguan kimia. Adanya atom lain yang lebih mudah mengion akan mengganggu karena ion tersebut akan mengalami eksitasi lebih dulu.
- Gangguan Fisika
Gangguan ini berasal dari sebab-sebab fisik. Misalnya pelarut yang berbeda dalam larutan standar, contohnya akan menimbulkan perbedaanukuran partikel kabut yang dibuat dalam spray chamber. Mudah atau lambatnya proses ini akan mempengaruhi absorbans yang diperoleh. Kurva standar yang melengkung dapat disebabkan oleh gangguan ini.
ALAT DAN BAHAN
- Spektrometer serapan atom
- Labu ukur 250 mL (4 buah), 100 mL (10 buah)
- Pipet ukur
- HNO3pekat
- Larutan standar Ca (1000 ppm)
- Larutan standar Sr (1000 ppm)
- Larutan K (10000 ppm)
- Larutan EDTA (1000 ppm)
- Larutan Fosfat (10000 ppm)
Cara Kerja
Preparasi Larutan Standar:
- Dibuat dari larutan standar Ca (1000 ppm), larutan seri dengan Volum 2 mL + X mL fosfat dalam labu ukur 100 mL (X = 0.00; 1.00; 2.00; 5.00; dan 10.00 mL)
- Diukur masing-masing emisinya pada kondisi optimum operasi alat (petunjuk Aslab). Dibuat kurva (grafik hubungan emisi terhadap Volume fosfat). Panjang gelombang yang digunakan yaitu 422,8 nm
Pengaruh “Masking Agent” :
- Dibuat seri larutan standar Ca yang mengandung 2 mL Ca 1000ppm + 2 mL larutan Fosfat 1000 ppm + X mL EDTA dalam labu ukur 100 mL (X = 0.00; 1.00; 2.00; 5.00; dan 10.00 mL)
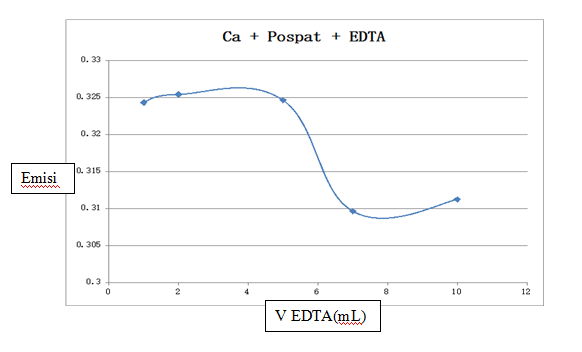
- Diukur masing-masing emisinya pada kondisi optimum operasi alat, dibuat kurva (grafik hubungan emisi terhadap Volume EDTA. Panjang gelombang yang digunakan yaitu 422,8 nm
Pengaruh “Releasing Agent” :
- Dibuat seri larutan standar Ca yang mengandung 2 mL Ca 1000 ppm + + 2 mL larutan Fosfat 1000 ppm + X mL Sr dalam labu ukur 100 mL (X = 1.00; 2.00; 5.00; 7.00 dan 10.00 mL)
- Diukur masing masing emisinya dengan AES. Dibuat kurva (grafik hubungan serapan terhadap Volume Sr). Panjang gelombang yang digunakan yaitu 422,8 nm
Data Pengamatan
| LARUTAN | E |
| Ca 2 ml + PO40 ml | 0,4788 |
| Ca 2 ml + PO4 1 ml | 0,326 |
| Ca 2 ml + PO4 2 ml | 0,3267 |
| Ca 2 ml + PO4 5 ml | 0,322 |
| Ca 2 ml + PO4 10 ml | 0,3164 |
| LARUTAN | E |
| Ca 2 ml + PO4 2 ml + EDTA 1 ml | 0,3243 |
| Ca 2 ml + PO4 2 ml + EDTA 2 ml | 0,3254 |
| Ca 2 ml + PO4 2 ml + EDTA 5 ml | 0,3246 |
| Ca 2 ml + PO4 2 ml + EDTA 7 ml | 0,3096 |
| Ca 2 ml + PO4 2 ml + EDTA 10 ml | 0,3112 |
| LARUTAN | E |
| Ca 2 ml + PO4 2 ml+ Sr 1 ml | 0,256 |
| Ca 2 ml + PO4 2 ml + Sr 2 ml | 0,257 |
| Ca 2 ml + PO4 2 ml + Sr 5 ml | 0,2281 |
| Ca 2 ml + PO4 2 ml + Sr 7 ml | 0,3095 |
| Ca 2 ml + PO4 2 ml + Sr 10 ml | 0,3924 |
PEMBAHASAN
Pada praktikum analisa instrumen kali ini dilakukan praktikum AES (Atomic Emission Spectroscopy). Praktikum ini bertujuan untuk mengetahui dan memahami instrumentasi AES dan mengetahui pengaruh Masking Agent dan Releasing Agent pada pengukuran AES. Atomic Emission Spectroscopy (AES) adalah suatu alat yang dapat digunakan untuk analisa logam secara kualitatif maupun kuantitatif yang didasarkan pada pemancaran atau emisi sinar dengan panjang gelombang yang karakteristik untuk unsur yang dianalisa yaitu 422,8 nm karena Ca menyerap di sekitar panjang gelombang tersebut.
Langkah pertama yang dilakukan yaitu menyiapkan larutan Ca, Sr, EDTA dan Fosfat masing masing 1000ppm. Kemudian dibuat campuran tertentu seperti pada petunjuk. Hal ini dilakukan untuk mengetahui :
Pengaruh Penambahan Fosfat pada Ca2+
P ada penentuan emisi kalsium yang ditambahkan larutan fosfat kita dapat melihat adanya gangguan yang biasa terjadi pada AES. Pada kasus ini merupakan gangguan Kimia. Ion fosfat yang ditambahkan dapat mengganggu spektrum emisi karena fosfat dengan kalsium dapat membentuk senyawa Ca3(PO4)2 yang dalam nyala sukar untuk diatomisasi. Hal ini disebabkan adanya ikatan yang cukup kuat dan stabil dalam garam Ca3(PO4)2. Ikatan tersebut cukup kuat dan sulit untuk diputuskan dalam proses atomisasi, hal ini mengakibatkan populasi atom Ca dalam nyala akan berkurang. Makin banyak penambahan ion fosfat kepada larutan maka akan semakin besar pula penurunan populasi dari atom Ca. Grafik yang ideal adalah dengan bertambahnya ion fosfat, maka emisi dari ion kalsium akan semakin berkurang.
3Ca2+ + (PO4)2 –> 3- Ca3(PO4)2
Hasil percobaan juga menunjukkan bahwa semakin besar konsentrasi PO4 dalam larutan maka nilai emisinya semakin turun. Grafik hasil percobaan yaitu
Pengaruh Penambahan Fosfat pada Ca2+ (yang dimasking oleh EDTA)
Pada percobaan yang kedua, dapat dilihat bagaimana penambahan EDTA sebagai masking agent dapat mengurangi gangguan dari Ion fosfat .Ca dengan EDTA dapat membentuk kompleks EDTA yang cukup stabil. Hal ini dikarenakan tetapan pembentukan kompleksnya yang cukup besar. Selain itu atom Ca dalam EDTA lebih mudah untuk diatomisasi dan EDTA tak menggangu dalam pembacaan emisi atom. Dalam hal ini EDTA berperan sebagai masking agent yang berfungsi untuk melindungi atom Ca dari gangguan fosfat sehingga keduanya (fosfat dan kalsium) tidak bereaksi membentuk Ca3(PO4)2.
EDTA sebagai masking agent yang melindungi atom Ca. EDTA akan berikatan dengan Ca sehingga Ca tidak lagi bereaksi dengan fosfat membentuk Ca3(PO4)2. Disamping itu, konsentrasi Ca dalam setiap labu adalah sama yaitu 10 ml sehingga emisi yang dihasilkan akan konstan (mendatar). Akan tetapi pada hasil percobaan diperoleh grafik sebagai berikut :
Grafik hasil percobaan menunjukkan bahwa emisi Ca tidak konstan,terdapat kenaikan dan penurunan garis. Hal ini mungkin disebabkan oleh banyak pengotor logam yang menganggu pembacaan. Ca3(PO4)2 + EDTA Ca-EDTA2+ + PO42-
Pengaruh Penambahan Sr pada Campuran Ca2+ dan PO42-
Pada percobaan yang ketiga, yaitu variasi penambahan Sr2+ pada campuran larutan Ca2+ dengan fosfat. Penambahan Sr menyebabkan terbentuknya Sr3(PO4)2. Sr bertindak sebagai releasing agent yang akan melepaskan Ca2+ dari Ca3(PO4)2 dan berikatan dengan fosfat sehingga emisi Ca2+ menjadi naik karena Ca2+ yang tdinya berikatan dengan fosfat akan bebas kembali. Ikatan ion antara Sr2+ dengan PO43- lebih stabil daripada ikatan antara Ca2+ dengan PO43-. Semakin banyak Sr yang di tambahkan maka semakin banyak Ca yang tereksitasi dalam nyala dan emisi Ca akan semakin besar. Dalam praktikum, jumlah Ca dan fosfat dibuat kosntan dan diberi variasi pada penambahan Sr.
3Sr2+ +Ca3(PO4)2 Sr3(PO4)2 + 3Ca2+
Pada grafik hasil percobaan didapat lonjakan emisi yang besar. Seharusnya grafiknya tak menunjukkan perubahan emisi yang signifikan, karena gangguan telah diatasi dengan Sr. Kemungkinan yang terjadi ialah terjadi gangguan spektal sehingga Sr terbaca menjadi Ca dan berakibat pada tingginya emisi dari Ca.
Beberapa kesalahan yang mungkin terjadi pada saat praktikum menyebabkan grafik yang tak sesuai seperti seharusnya misalnya pada saat pemipetan tak akurat, pengenceran tak tepat, pencucian peralatan yang belum bersih, atau penggunaan instrumen yang belum tepat sempurna.
PERTANYAAN (berdasarkan percobaan pada diktat)
- Apa yang Anda amati pada percobaan 1? Jelaskan!
semakin banyak larutan fosfat yang ditambahkan ke larutan standar Ca maka nilai emisinya akan semakin kecil karena fosfat merupakan ion pengganggu
- Apa yang Anda amati pada percobaan 2? Jelaskan!
Nilai emisinya lebih besar dari percobaan 1. Ini terjadi karena dalam campuran ditambahkan EDTA yang berfungsi sebagai masking agent yang menjaga Ca dari gangguan fosfat
Jelaskan apa yang Anda amati pada percobaan 3!
Pada percobaan 3, larutan Ca fosfat dengan Sr memiliki nilai emisi nyala lebih besar disbanding percobaan 1, sebab Sr berfungsi sebagai releasing agent atau pelepas Ca dari fosfat dan terbentuk Sr fosfat, sehingga larutan Ca lebih murni. Tetapi dibandingkan dengan percobaan 2, nilai emisinya masih lebih kecil. Karena EDTA jauh lebih baik untuk memurnikan larutan kalsium, karena kekuatan sebagai masking agent lebih besar dibanding releasing agent.
KESIMPULAN
- Spektroskopi emisi nyala digunakan untuk mendeteksi atom golongan IA dan IIA
- Sering terjadi gangguan spektral pada aes karena tak adanya sumber lampu
- Posfat berperan sebagai ion pengganggu
- Sr berperan sebagai releasing agent
- EDTA berperan sebagai masking agent
DAFTAR PUSTAKA
- John Wiley Sons. 1984. Chemistry Experiments:AA andAE spectroscopy
- Sunardi. 2011. Penuntun Praktikum Kimia Analisa Instrumentasi. Depok: Departemen Kimia FMIPA UI
- Day R.A. dan A.L Underwood. 2002. Analisis Kimia Kuantitatif, edisi keenam. Jakarta : Erlangga
- New images reveal interstellar comet’s ‘heartbeat’ - December 26, 2025
- Perbaikan Mobil Bekas Banjir, Bisa Pulih Sepenuhnya? - December 26, 2025
- Dewan Perwakilan Rakyat Ohio menyetujui rancangan undang-undang NASA Day of Remembrance; Senat akan mempertimbangkannya - December 26, 2025



3 comments