Nano Catalyst untuk mengkonversi CO2 menjadi Hydrocarbons
Pendahuluan
Pada dasarnya nanokatalis ialah nanopartikel yang digunakan/berfungsi sebagai katalis. Dalam nanoteknologi, sebuah partikel didefinisikan sebagai sebuah benda kecil yang berperilaku sebagai satu kesatuan yang utuh sehubungan sifatnya. Nanopartikel berukuran antara 1 sampai 100 nanometer. Contoh bahan yang memiliki satu dimensi dalam skala nano (dan diperluas dua dimensi) adalah lapisan, seperti film tipis atau permukaan coating. Beberapa fitur chip komputer datang dalam kategori. Bahan yang nano dalam dua dimensi termasuk kawat nano dan nanotube.Bahan yang nano dalam tiga dimensi adalah partikel, misalnya endapan, koloid, dan titik-titik kuantum (partikel kecil bahan semikonduktor). Bahan nanokristali juga termasuk dalam kategori ini.Beberapa bahan telah tersedia untu saat ini sedangkan bahan lain yang ada masih benar-benar baru (Taniguchi, 1974; Lubick dan Betts, 2008; Edelstein dan Cammarata, 1998).
Keuntungan dan kelemahan
Seperti halnya nanopartikel yang kita ketahui memiliki banyak keuntungan dibandingkamn senyawa ukuran normal. Begitu pula nanokatalis. Beberapa keuntungannya meliputi :
Selektifitas sangat tinggi
aktifitas yang sangat tinggi (ekstrim)
konsumsi energi rendah
waktuhidup (Umur katalis) yang panjang
Limbah yang minimum
Beberapa kekurangannya :
Biaya pembuatannya yang lebih mahal
Belum bisa dibuat untuk semua jenis katalis
Nanokatalis
Katalis yang digunakan ialah katalis heterogen Ru:Mn:Ni untuk mengkonversi gas CO2 menjadi Hidrokarbon
Sintesis
Larutan rutenium triklorida (0,103 g), nitrat mangan terhidrat ( 2,285 g) dan nikel nitrat hexahydrate (2.47 g) dalam air deionisasi, diasamkan dengan asam klorida encer untuk mencegah pengendapan hidroksida. Sebagian dari campuran (10 cm3) ditambahkan ke titanium dioksida support catalyst (3,95 g), (350 m2g-1) di tempat penguapan dan campuran diaduk dengan magnetic stirrer. campuran diaduk selama 20 menit dan dikeringkan pada 395 K semalam. Sampel katalis dikalsinasi selama 6 jam pada 600 ° C. rasio yang berbeda dari Ru, Mn dan Co berkisar antara 2-3% Ru, Ni 20-30%, Mn 15-20% disiapkan dan dilakukan pengujian katalitik. Sampel dengan Ru 2%, Ni 20%, 15% Mn diketahui menjadi yang terbaik dan akhirnya dipilih untuk karakterisasi lebih lanjut dan pengujian katalitik. Sampel ditetapkan sebagai SM-1.
Karakterisasi
SEM/TEM
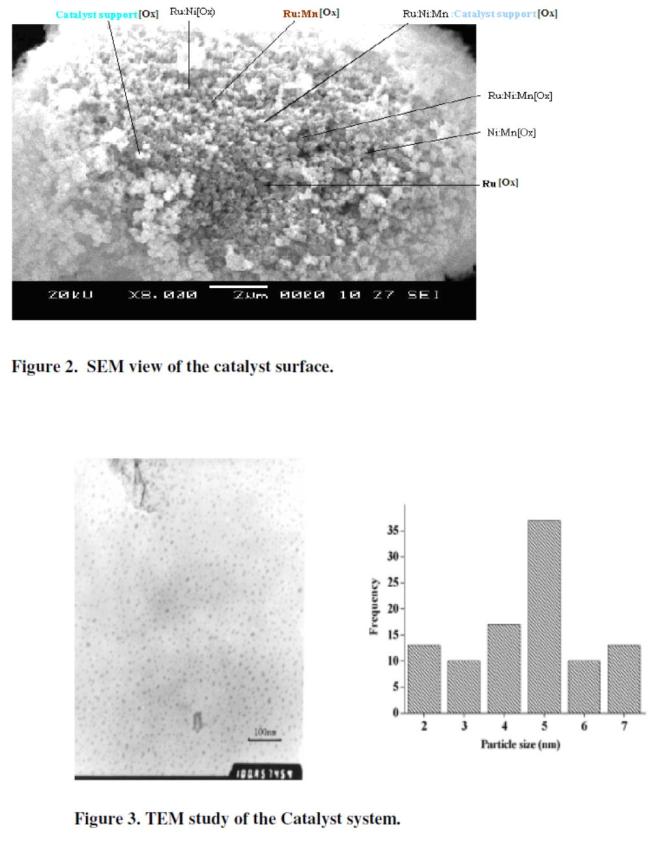
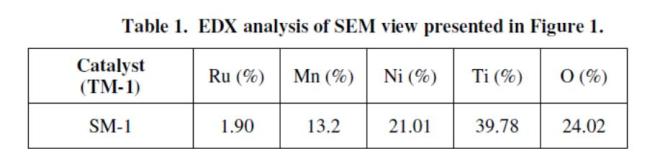
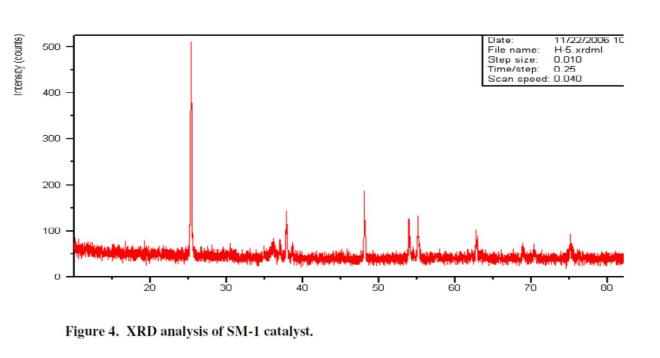
Morphology and geometry permukaan dari situs aktif katalis dan interaksinya dengan support telah dipelajari dengan SEM dan hasilnya bisa dilihat di Figure 2 dan hasil TEM pada figure 3. Tabel 1 memperlihatkan hasil dari EDX. Analysis menunjukkan persentasi komposisi dari logam yang terdispersi didalam pori TiO2 support.
Karakterisasi Katalis Menggunakan XRD (X-ray difraksi)
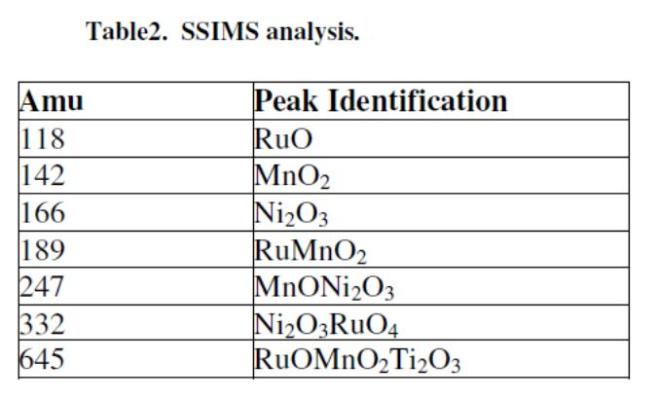
Hasil analisis XRD dari SM-1 katalis disajikan pada Figure 4. Sekitar 0,5 g. dari sampel bubuk itu ditekan ke jendela kaca dibelakangi oleh slide kaca dan dirapikan dengan spatula. Sampel diletakkan ke dalam ruang difraksi, dan discan dari sudut Bragg 2ϴ = 16 ° sampai 2 ϴ = 70 °. Identifikasi puncak dilakukan dengan perbandingan spektra diukur dengan ASTM (American Society untuk Pengujian Bahan) file data bubuk. Ukuran partikel dihitung dari data XRD menggunakan persamaan Scherrer dihasilkan 5 nm.
Characterization of Catalyst using SSIMS
Tabel 2 menunjukkan analisis ion sekunder dari spektra SSIMS, yang jelas mengindikasikan interaksi Ru,
Mn, dan Ni (Ox) membentuk geometri permukaan trimetallic. Interaksi Ru:Ni:Mn (Ox) dengan titanium dioxide diamati
Characterization of Catalyst Using XPS
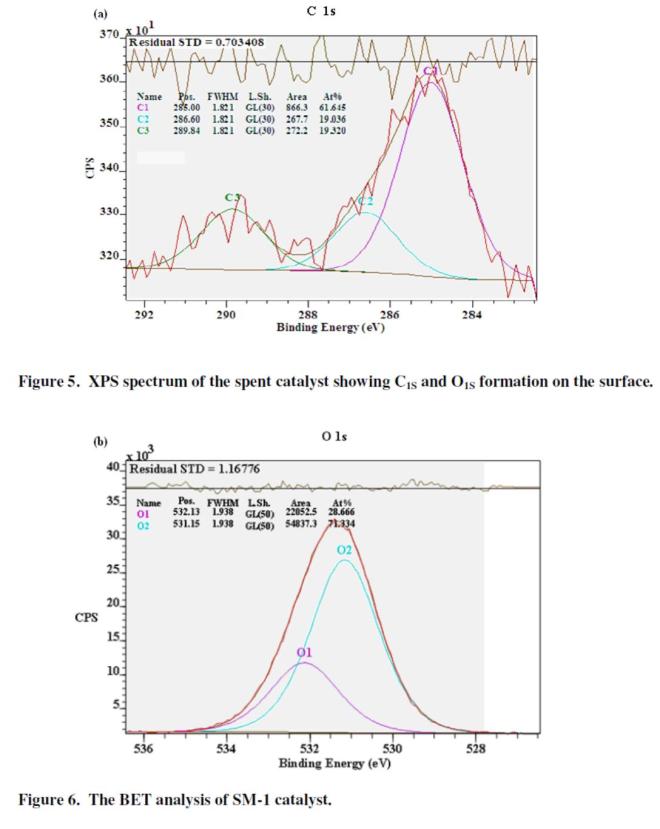
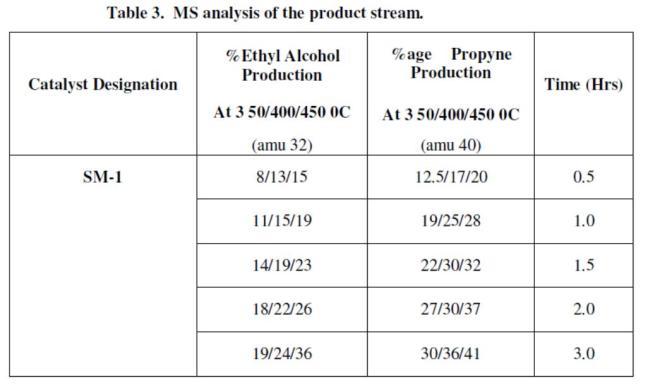
Analisis XPS pada SM-1 untuk C1S dan O1S dilakukan dan hasilnya ditunjukkan di Figure 5. Bisa dilihat bahwa carbon dihasilkan dari dekomposisi dari transformasi CO2 di tipe C1, C2 and C3 pada permukaan katalis dan dari dekomposisi air menjadi 2 tipe oksigen O1 dan O2.
Mekanisme Reaksi
Mekanisme menggambarkan bahwa elektron terakumulasi pada support selama reaksi, ditransfer ke dalam kisi dari Ru / Co untuk aktivasi CO2 di permukaan dengan polarisasi linier CO2 ke molekul CO2 untuk berinteraksi dengan situs katalis aktif untuk membuat kompleks (I). Kompleks (I) melakukan rearrangement hingga menjadi spesies (II), (III),(IV), dan (V) dll.Spesies (II) dan (III) mengabstraksi oksigen dengan pembelahan O-C dan pembentukan ikatan OO untuk membentuk spesies (VI), eliminasi reduktif dari O2 menghasilkan spesies (VII). Ini adalah langkah kunci dalam aktivasi dan dekomposisi karbon dioksida. Spesies (IV) dan (V) tampaknya tidak terdapat dalam jumlah yang cukup sebagai asam format atau formaldehyde tidak terdeteksi dalam aliran produk. Namun, keberadaan spesies ini tidak dapat dikesampingkan sama sekali, studi lebih lanjut direncanakan untuk mengkonfirmasi hipotesis. Spesies (VII) yang baru terbentuk bereaksi dan M-C bereaksi dengan permukaan teradsorb HOH untuk membentuk species (VIII). splitting dari H2O melalui (a) and (b). Langkah (a) menuju pada dekomposisi dari air dengan mengabstrak oksigen untuk membentuk kompleks yang mengandung molekul oksigen dan hidrida logam. Eliminasi reduktif dari O2 dan insersi of carbon ke ikatan M-H menghasilkan pembentukan H-MCH3,H-M-C-CH3 dan H-MC-C-CH3. Setelah mengalami langkah eliminasi reduktif, propene dieliminasi, dan catalyst diregenerasi. Akumulasi dari electrons dalam padatan n-type semi conducting support ditingkatkan oleh keberadaan ion mangan bertingkat valensi tinggi sebagai katalis trimetallic. Pada (b)air diadsorb pada permukaan species (VII) oksidatif ditambahkan ke logam untukmemberi kompleks hidrida dan hidrokso dalam menghasilkan species (XIII) yang pada eliminasi reduktif C2H5OH dan O2 diregenerasi untuk menjalani reaksi dalam mode auto-thermal. Air teradsorb di permukaan katalis, Ru, pada bilayers sebagian terdissosiasi dengan satu ikatan OH putus seperti pada yang telah dilaporkan sebelumnya
Manfaat
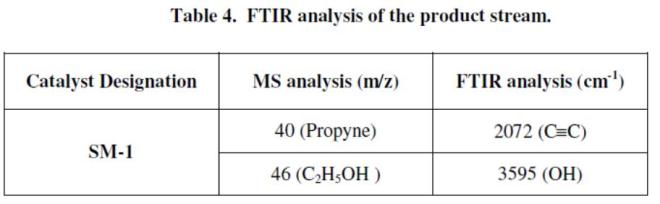
Carbgas, uap and 1% hydrogen dengan kecepatan antara 6000-7200/h dilewatkan pada catalyst dalam fixed bed reactor, pada 773 K. Dan berbagai hasilnya dapat dilihat pada tabel 3 dan 4
Konversi CO2 :
Conversion [reactants]i = [reactants)i(in) –[reactants]i(out)/[reactants]i(in)} x 100%
yield produk:
Yield [mol%]i = [products]i/[(O2)in + [H2O]in + [O2]in
Selektivitas produk dihitung :
Selectivity [product]i = [(jumlah carbon]x [product]i] /[jumlah carbon terkonversi] x 100%
Kesimpulan
The carbgas (CO2 + H2O + H2) dikonversi menjadi ethyl alcohol dan propyne pada 773 K dan tekanan normal
Keberadaan dari tingkat oksidasi yang berbeda dari sistem trimetallic support catalyst memutus ikatan H-OH and C-O.
Geometri yang spesifik dari Ru, Mn, Ni, and TiO2 merupakan kunci dari reaksi katalisis.




Post Comment