Rangkuman Elektrokimia Singkat
Potensial Elektrokimia
Elektron yang dihasilkan pada anoda bergerak ke katoda
dengan gaya elektromotif (emf).
• Gaya ini timbul karena adanya perbedaan energi potensial
listrik elektron antara 2 elektroda.
• Kerja yang dilakukan sebanding dengan jumlah elektron
(jumlah muatan listrik) yang bergerak dari energi potensial
tinggi ke energi potensial rendah dan pada beda energi
potensial.
Kerja listrik = muatan x beda energi potensial
W (joule) = 1 volt x 1 coulomb
1 colulomb adalah jumlah muatan yang melalui suatu titik dalam
suatu sirkuit dimana arus 1 ampere mengalir selama 1 detik.
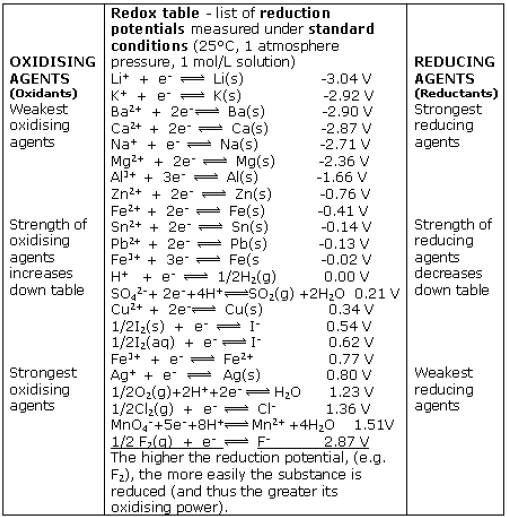
Potensial Elektroda Standar
• Potensial elektroda standard adalah jumlah kuantitatif yang
menyatakan kecenderungan suatu reaktan dalam keadaan
standar untuk menghasilkan produk
ΔG orxn = ‐nFE o
• Reaksi akan menghasilkan produk jika mempunyai nilai
E o > nol
Menghitung Potensial E o dalam Suatu Sel Elektrokimia
Zn→ Zn 2+ + 2e
Cu 2+ + 2e →Cu
Zn + Cu 2+ → Zn2+ + Cu
Potensial hidrogen standard:
2 H3O + (aq)+ e → H2(g, 1bar) + 2 H2O (l) E o = 0.00 V
Menggunakan Potensial Standar
Sel Elektrokimia Pada Keadaan Tidak Standar
E = Eo – (RT/nF).ln Q
Pada keadaan setimbang
Aplikasi Elektrokimia
• Baterai
– Primer / Nonrechargable: baterai alkalin; baterai merkuri,
perak; baterai Li
– Sekunder / Rechargable: Lead‐Acid battery, (Ni‐MH)
battery, Lithium‐ion battery
• Fuel cell
• Elektroplating
• Pencegahan korosi (Baca artikel penjelasan korosi lengkap)
- FK Unusa Kolaborasi dengan Universiti Sains Malaysia, Tingkatkan IPM Melalui Program Fellowship - February 21, 2026
- Bumbu - February 21, 2026
- 1.708 Mahasiswa Dilantik, Rektor UPGRIS: Ormawa Jadi Laboratorium Kehidupan - February 21, 2026




4 comments