Ringkasan Materi Ikatan Kimia
Ikatan kimia : ikatan yang terjalin secara terpadu antara dua atom atau lebih dalam suatu molekul.
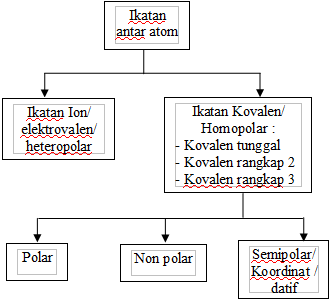
Ruang Lingkup Ikatan
Hakikat Ikatan : setelah berikatan susunan elektron masing-masing atom mencapai kestabilan.
Kestabilan (Teori Oktet Lewis)
Atom menjadi stabil jika memiliki susunan elektron seperti gas mulia dengan serah terima elektron (ikatan ion) atau dengan perseketuan elektron (ikatan kovalen).
Unsur-unsur gas mulia yaitu :
2He : 2
10Ne : 2, 8
18Ar : 2, 8, 8
36Kr : 2, 8, 18, 8
54Xe : 2, 8, 18, 18, 8
86Rn : 2, 8, 18, 32, 18, 8
Unsur yang no. atomnya 5 (H, He, Li, Be, B) cenderung memiliki 2 elektron seperti Helium (duplet)
Unsur yang no. atomnya > 5 cenderung memiliki 8 elektron di kulit terluar (oktet)
Unsur sekitar gas mulia
|
IA |
IIA |
IIIA |
VIIIA |
VIA |
VIIA |
|
3Li 11Na 19K 37Rb 55Cs |
4Be 12Mg 20Ca 38Sr 56Ba |
5B 13Al |
2He 10Ne 18Ar 36Kr 54Xe |
😯 16S 34Se 52Te |
7F 17Cl 35Br 53I |
===================>>> Memberikan elektron
Menerima elektron<<<========================
Ikatan Ion/Heteropolar/Elektrovalen
Pengertian :
-
Ikatan yang terjadi akibat perpindahan elektron
-
Ikatan antara atom yang melepaskan elektron (logam) dengan atom yang menangkap elektron (bukan logam)
-
Ikatan antara gol. IA & IIA dengan golongan VIA dan VIIA
-
Ikatan antara ion positif dan ion negatif
-
Ikatan antara atom-atom yang perbedaan keelektronegatifannya besar
-
Ikatan antara atom-atom yang mempunyai potensial ionisasi rendah dengan atom-atom yang mempunyai afinitas elektron tinggi
Catatan :
-
Jika atom memiliki elektron valensi 1, 2, atau 3, maka atom itu cenderung melepaskan elektron.
-
Jika atom memiliki elektron valensi 4, 5, 6, atau 7, maka atom itu cenderung menangkap elektron.
-
Jika atom memiliki elektron valensi 8, maka susunan elektronnya stabil.
Pembentukan Ion Positif
Golongan Alkali
|
Unsur |
Konfigurasi elektron |
Elektron valensi |
|
3Li |
2, 1 |
1 |
|
11Na |
2, 8, 1 |
1 |
|
19K |
2, 8, 8, 1 |
1 |
|
37Rb |
2, 8, 18, 8, 1 |
1 |
|
55Cs |
2, 8, 18, 18, 8, 1 |
1 |
|
87Fr |
2, 8, 18, 32, 18, 8, 1 |
1 |
Golongan Alkai Tanah
|
Unsur |
Konfigurasi elektron |
Elektron valensi |
|
4Be |
2, 2 |
2 |
|
12Mg |
2, 8, 2 |
2 |
|
20Ca |
2, 8, 8, 2 |
2 |
|
38Sr |
2, 8, 18, 8, 2 |
2 |
|
56Ba |
2, 8, 18, 18, 8, 2 |
2 |
|
88Ra |
2, 8, 18, 32, 18, 8, 2 |
2 |
Konfigurasi elektron ion alkali = konfigurasi elektron ion alkali tanah = konfigurasi elektron gas mulia
|
Ion alkali |
Ion alkali tanah |
Konfigurasi Elektron |
|
3Li+ |
4Be+ |
2 |
|
11Na+ |
12Mg+ |
2, 8 |
|
19K+ |
20Ca+ |
2, 8, 8 |
|
37Rb+ |
38Sr+ |
2, 8, 18, 8 |
|
55Cs+ |
56Ba+ |
2, 8, 18, 18, 8 |
|
87Fr+ |
88Ra+ |
2, 8, 18, 32, 18, 8 |
Pembentukan Ion Negatif
Golongan VIIA
|
Unsur |
Konfigurasi elektron |
Elektron valensi |
|
9F |
2, 7 |
7 |
|
17Cl |
2, 8, 7 |
7 |
|
35Br |
2, 8, 18, 7 |
7 |
|
53I |
2, 8, 18, 18, 7 |
7 |
|
85At |
2, 8, 18, 32, 18, 7 |
7 |
Golongan VIA
|
Unsur |
Konfigurasi elektron |
Elektron valensi |
|
😯 |
2, 6 |
6 |
|
16S |
2, 8, 6 |
6 |
|
34Se |
2, 8, 18, 6 |
6 |
|
52Te |
2, 8, 18, 18, 6 |
6 |
Konfigrasi elektron ion halogen = konfigurasi elektron ion golongan oksigen = konfigurasi elektron gas mulia
|
Ion halogen |
Ion gol. Oksigen |
Konfigurasi Elektron |
|
9F- |
8O2- |
2, 8 |
|
17Cl- |
16S2- |
2, 8, 8 |
|
35Br- |
34Se2- |
2, 8, 18, 8 |
|
53I- |
52Te2- |
2, 8, 18, 18, 8 |
|
85At- |
8O2- |
2, 8, 18, 32, 18, 8 |
Proses Pembentukan Ikatan Ion
Contoh : Pembentukan senyawa MgF2
1 2Mg (2, 8, 2) → Mg2+ (2, 8) + 2e x 1
9F (2, 7) + e → F- (2, 8) x 2
———————————————————-
M g (2, 8, 2) + 2F (2, 7) → Mg2+ (2, 8) + 2F- (2, 8)
Mg2+ + F- → MgF2
Contoh senyawa Ion :
-
Gol. Alkali (IA) dan Gol. Halogen (VIIA)
NaF, NaBr, KI, KBr, RbI, CsF, LiF
-
Gol. Alkali (IA) dan Gol. VIA
Na2O, Na2S, K2O, Rb2S
-
Gol. Alkali Tanah (IIA) dan Gol. Halogen (VIIA)
CaBr2, CaF2, MgBr2, SrCl2, CaCl2, MgI2
-
Gol. Alkali Tanah (IIA) dan Gol. VIA
MgO, CaO, CaS, BaO, SrO, MgS
-
Ikatan Ion (dari ion logam dan ion non logam )
KH, CaH2, Mg3N2, LiN, CaC2, AlCl3, Al2O3
Ikatan Kovalen/Homopolar
Pengertian
-
-
Ikatan yang terjadi akibat pemakaian pasangan elektron secara bersama-sama
-
Ikatan antara atom-atom yang sama-sama ingin menangkap elektron (sesama atom bukan logam)
-
Ikatan antara atom-atom yang perbedaan keelektronegatifan rendah
-
Pembagian

-
Ikatan kovalen tunggal : penggunaan sepasang elektron bersama. Contoh :
Rumus Kimia
H2
HCl
H2O
NH3
CH4
Rumus Lewis
H H
H Cl
H O
H
H
N H
H
H
H C H
H
Rumus Struktur
H H
H Cl
H O H
H
N H
H
H
H C H
H
-
Ikatan kovalen rangkap 2 : penggunaan 2 pasang elektron bersama. Contoh :
|
Rumus Kimia |
O2 |
CO2 |
C2H4 |
|
Rumus Lewis |
O O |
O C O |
H H H C C H |
|
Rumus Struktur |
O =O |
O =C= O |
H H H C= C H |
Penyimpangan Kaidah Oktet
Penyimpangan aturan oktet dibagi tiga kelompok, yaitu :
-
-
-
Senyawa yang tidak mencapai aturan oktet, yaitu senyawa yang atom pusatnya mempunyai elektron valensi kurang dari 4, sehingga setelah semua elektron valensinya dipasangkan tetap belum mencapai kaidah oktet. Contoh: BeCl2, BCl3, dan AlBr3.
-
-
-
-
-
Senyawa dengan jumlah elektron valensi ganijl, contoh : NO2.
-
-
-
-
-
Senyawa yang melampaui aturan oktet, Unsur dari periode 3 atau lebih dapat menampung lebih dari 8 elektron pada kulit terluarnya. Contoh : PCl5, SF6, ClF3, IF7, dan SbCl5.
-
-
-
Ikatan kovalen rangkap 3 : penggunaan 3 pasang elektron bersama. Contoh :
Rumus Kimia
N2
HCN
C2H2
Rumus Lewis
N N
H C N
H C C H
Rumus Struktur
N N
H C N
H C C H
Catatan :
Pasangan elektron yang dipakai bersama-sama disebut Pasangan Elektron Ikatan (PEI) sedangkan yang tidak dipakai dalam ikatan disebut Pasangan Elektron Bebas (PEB). Contoh :
Rumus Kimia
O2
N2
CH4
NH3
H2O
PEI
2
3
4
3
2
PEB
4
2
–
1
2
-
Ikatan kovalen koordinasi = ikatan semi polar : Pasangan elektron milik bersama hanya disumbangkan oleh satu atom, sedangkan atom yang satu lagi tidak menyumbangkan elektron. Contoh : NH4Cl, NH3BH3, H2CO3, H2SO4, HNO3, SO3, H3PO4.
-
-
Syarat terjadinya ikatan kovalen koordinasi yaitu bila salah satu atom mempunyai PEB.
-
Ikatan Kovalen Polar dan Kovalen Non Polar
Banyaknya atom yang berikatan
Ikatan Kovalen Polar
Ikatan Kovalen Non Polar
Molekul yang terbentuk dari dua atom
Terjadi bila PEI tertarik lebih kuat ke salah satu atom (kedua atom tidak sejenis)
Contoh :
HF, HCl, HBr, ICl, IF, ClF.
Terjadi bila PEI tertarik sama kuat ke kedua atom (kedua atom sejenis)
Contoh :
Cl2, O2, I2, Br2, N2, F2, H2.
Molekul yang terbentuk dari tiga atom atau lebih
Terjadi bila atom pusat mempunyai PEB, sehingga PEI tertarik lebih kuat ke atom pusat, akibatnya bentuk molekul tidak simetris.
Contoh :
H2O, NH3, PCl3, Cl2O, OF2.
– Senyawa polar karena pengaruh struktur ruang. Contoh : CHCl3.
Terjadi bila atom pusat tidak mempunyai PEB, sehingga PEI tertarik sama sama kuat ke semua atom akibatnya bentuk molekul simetris.
Contoh :
CH4, CCl4, BH3, BCl3, PCl5, CO2, CS2.
Catatan : Atom pusat yaitu atom yang persis ditengah-tengah molekul.
-
-
|
Rumus Kimia |
BCl3 |
NO2 |
PCl5 |
|
Rumus Lewis |
Cl Cl B Cl |
O N O |
Cl Cl P Cl Cl Cl |
|
Rumus struktur |
Cl Cl B Cl |
O N O |
Cl Cl P Cl Cl Cl |
Bentuk Molekul Senyawa
Untuk meramalkan bentuk molekul sederhana dapat ditempuh melalui langkah – langkah sebagai berikut:
-
Menentukan elektron valensi tiap atom
-
Menentukan jumlah elektron yang digunakan untuk ikatan, yaitu dengan cara menjumlahkan elektron valensi atom pusat dengan elektron-elektron dari atom yang mengelilingi atom pusat.
-
Menentukan banyaknya pasangan elektron total (PE), yaitu dengan cara : banyaknya elektron yang digunakan untuk ikatan dibagi dua.
-
Menentukan banyaknya pasangan elektron terikat (PEI).
-
Menentukan banyaknya pasangan elektron bebas (PEB) dengan cara : jumlah pasangan elektron total (PE) dikurangi banyaknya pasangan elektron terikat (PEI).
Tabel berbagai kemungkinan bentuk molekul senyawa
|
Σ PEI |
Σ PEB |
Bentuk Molekul |
Contoh |
|
4 |
0 |
Tetrahedron |
CH4 |
|
3 |
1 |
Piramida trigonal |
NH3 |
|
2 |
2 |
Planar bentuk V |
H2O |
|
5 |
0 |
Bipiramida trigonal |
PCl5 |
|
4 |
1 |
Bidang empat |
SF4 |
|
3 |
2 |
Planar bentuk T |
IF3 |
|
2 |
3 |
Linier |
XeF3 |
|
6 |
0 |
Oktahedron |
SF6 |
|
5 |
1 |
Piramida sisiempat |
IF5 |
|
4 |
2 |
Segi empat planar |
XeF4 |
Post Comment