Memahami Apa Itu SEL VOLTA
Hallo teman-teman kembali lagi dengan saya si (Penulis ) 😆 . Ada yang tahu apa itu Sel volta ? bagi yang belum tahu apa itu Sel volta & dan ingin cari – cari, langsung saja yuk lanjut baca artikel ini. Mengenai Sel Volta, langsung saja cekidot 😀 . Memahami Apa Itu SEL VOLTA
Sel volta (sel galvani) adalah sel elektrokimia yang di mana energi kimia dari reaksi redoks spontan diubah menjadi energi listrik. Prinsip kerja sel volta dalam menghasilkan arus listrik adalah aliran transfer elektron dari reaksi oksidasi di anode ke reaksi reduksi di katode melalui rangkaian luar.
Baca juga : Ringkasan Materi Redoks dan Elektrokimia
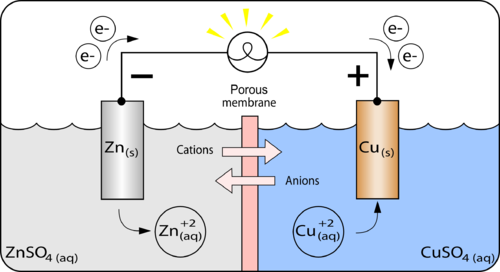
Susunan Sel Volta
Secara umum, sel volta tersusun dari:
- Anode, yaitu elektrode tempat terjadinya reaksi oksidasi.
- Katode, yaitu elektrode tempat terjadinya reaksi reduksi.
- Elektrolit, yaitu zat yang dapat menghantarkan listrik.
- Rangkaian luar, yaitu kawat konduktor yang menghubungkan anode dengan katode.
- Jembatan garam, yaitu rangkaian dalam yang terdiri dari larutan garam. Jembatan garam memungkinkan adanya aliran ion-iondari setengah sel anode ke setengah sel katode, dan sebaliknya sehingga terbentuk rangkaian listrik tertutup.
Notasi Sel Volta
Susunan sel volta dapat dinyatakan dengan notasi sel volta yang disebut juga diagram sel. Untuk contoh sel volta di atas, notasi selnya dapat dinyatakan sebagai berikut.
Zn | Zn2+ || Cu2+ | Cu
atau
Zn(s) | Zn2+(aq) || Cu2+(aq) | Cu(s)
Rangkaian Sel Volta
Contoh rangkaian sel volta. Sel volta terdiri dari beberapa bagian, yaitu:
- voltmeter, untuk menentukan besarnya potensial sel.
- jembatan garam (salt bridge), untuk menjaga kenetralan muatan listrik pada larutan.
- anode, elektrode negatif, tempat terjadinya reaksi oksidasi. pada gambar, yang bertindak sebagai anode adalah elektrode Zn/seng (zink electrode).
- katode, elektrode positif, tempat terjadinya reaksi reduksi. pada gambar, yang bertindak sebagai katode adalah elektrode Cu/tembaga (copper electrode).
Proses Dalam Sel Volta
Pada anode, logam Zn melepaskan elektron dan menjadi Zn2+ yang larut.
Zn(s) → Zn2+(aq) + 2e–
Pada katode, ion Cu2+ menangkap elektron dan mengendap menjadi logam Cu.
Cu2+(aq) + 2e– → Cu(s)
hal ini dapat diketahui dari berkurangnya massa logam Zn setelah reksi, sedangkan massa logam Cu bertambah. Reaksi total yang terjadi pada sel volta adalah:
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Demikian artikel Memahami Apa Itu SEL VOLTA , semoga bermanfaat dan silahkan berkomentar jika ada pertanyaan.
Sumber untuk gambar cover : pixabay



1 comment