Rangkuman Materi Stoikiometri
I. HUKUM DASAR ILMU KIMIA
a. Hukum Kekekalan Massa (Hukum Lavoisier)
“Massa zat sebelum dan sesudah reaksi adalah sama”.
Contoh:
S + O 2 → SO 2
32 gr 32 gr 64 gr
b. Hukum Perbandingan Tetap (Hukum Proust)
“Perbandingan massa unsur dalam tiap senyawa adalah tetap”
Contoh:
H 2 O → massa H : massa O = 2 : 16 = 1 : 8
c. Hukum Perbandingan Berganda (Hukum Dalton)
“Jika dua unsur dapat membentuk dua senyawa atau lebih, dan massa salah satu unsur sama, perbandingan massa unsur kedua berbanding sebagai bilangan bulat dan sederhana”.
Contoh:
– Unsur N dan O dapat membentuk senyawa NO dan NO 2
– Dalam senyawa NO, massa N = massa O = 14 : 16
– Dalam senyawa NO 2 , massa N = massa O = 14 : 32
– Perbandingan massa N pada NO dan NO 2 sama maka
perbandingan massa O = 16 : 32 = 1 : 2
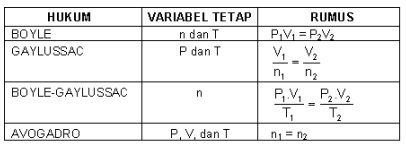
d. Hukum Gas Ideal
Untuk gas ideal atau suatu gas yang dianggap ideal berlaku rumus :
PV = n RT
Keterangan:
P = tekanan (atmosfir)
V = volume (liter)
n = mol = gram/Mr
R = tetapan gas (lt.atm/mol.K)
T = suhu (Kelvin)
Dari rumus tersebut dapat diperoleh :
II. MASSA ATOM RELATIF DAN MASSA MOLEKUL RELATIF
III. KONSEP MOL
a. Dalam ilmu kimia satuan jumlah yang digunakan adalah mol
b. satu mol adalah sejumlah zat yang mengandung 6,02 x 10^23 partikel
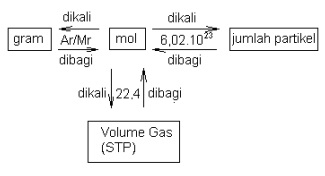
Hubungan Mol dengan jumlah partikel
Jumlah Partikel = mol x 6,02 x 10^23
mol = Jumlah partikel / 6,02 x 10^23
Hubungan Mol dengan Massa
Untuk unsur :
- mol = gram / Ar
- gram = mol x Ar
Untuk senyawa :
- mol = gram/Mr
- gram = mol x Mr
Hubungan Mol dengan Volume Gas
Setiap satu mol gas apa saja keadaan standard (0oC, 1 atm) mempunyai volume : 22, 4 liter.
- Volume gas = mol x 22,4
- mol = Volume / 22,4
Hubungan mol, jumlah partikel dan hubungan gas dapat digambarkan dalam bentuk
diagram sebagai berikut :
2 Poin terakhir silahkan lanjut ke halaman berikutnya ya
- Pembaruan Nasional: Tarif BPJS Kesehatan Kelas 1, 2, dan 3 Tahun 2026 - January 16, 2026
- Family Wellness: 5 Simple Tips to Avoid Illness This Winter - January 16, 2026
- Angka kematian akibat narkoba di seluruh dunia lebih dari dua kali lipat dalam tiga dekade terakhir, menurut sebuah studi. - January 16, 2026




15 comments