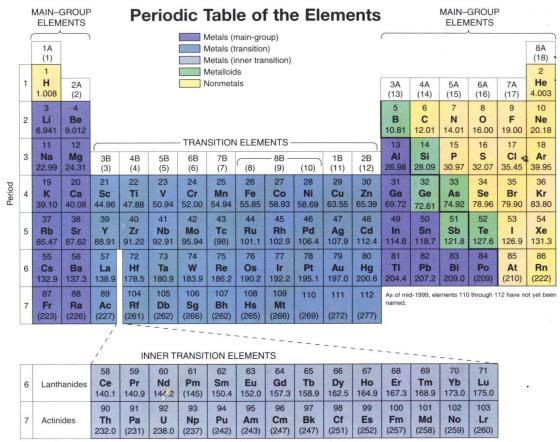
Pernahkah kalian mengamati sistem periodik unsur? Manakah yang termasuk unsur alami dan mana yang termasuk unsur buatan?
Unsur-unsur di alam lebih banyak berupa senyawa dibandingkan dalam keadaan bebas sesuai bentuk unsurnya. Unsur gas mulia terdapat dalam bentuk bebas dan unsur gas mulia ditemukan dalam bentuk senyawa alami di alam. Unsur-unsur gas mulia (helium, neon, argon, kripton, xenon, dan radon) termasuk dalam 90 jenis unsur yang terdapat di alam, sedangkan sisanya merupakan unsur buatan seperti plutonium dan amerisium. 118 unsur yang diketahui, sekitar 90 unsur berada di alam dan sisanya merupakan unsur sintesis (unsur buatan). Unsur-unsur di alam lebih banyak berupa senyawa dari pada unsur bebas, contoh unsur bebas di alam adalah unsur pada golongan VIII A ( gas mulia ) diantaranya , ( He, Ne, Ar, Kr, Xe, Rn).
Mengapa gas mulia terdapat secara bebas di alam?
Gas mulia termasur unsur yang sangat sulit mebentuk senyawa, disebabkan oleh elektron valensinya yang stabil yaitu octet ( 8 ) dan Duplet ( 2 ).
Sebagian besar senyawa di dapatkan dari hasil pertambangan , senyawa atau unsur-unsur di alam yang mengandung logam penting di sebut mineral. Sedangkan mineral yang mengandung senyawa atau unsur penting disebut bijih.
Tahukan anda unsur apa yang paling banyak di alam ini?
Ternyata salah satu unsur yang banyak di alam ini adalah Helium ( He ) unsur gas mulia ini di temukan dan dinyatakan terbanyak dialam oleh para Kimiawan dan terdapat di matahari.
Sedangkan udara yang kita hirup setiap hari mengandung nitrogen dan oksigen sebagai bahan yang paling banyak dan paling melimpah di udara.
Helium adalah unsur kimia berwujud gas yang tidak berwarna, tidak berbau, dan tidak berasa (pada suhu kamar). Helium termasuk dalam kelompok gas mulia yang memiliki jari-jari atom terkecil dan mempunyai berat atom kedua terendah. Hal inilah yang menyebabkan helium lebih ringan dari udara dan helium merupakan unsur umum kedua di alam semesta ini.
Kebanyakan orang hanya tahu bahwa helium digunakan sebagai gas pengisi untuk mengangkat “airship” dan balon udara, tetapi sebenarnya masih banyak kegunaan atau fubgsi lain dariyang belum diketahui orang. Manfaat utama unsur Helium sebenarnya adalah sebagai gas pendingin untuk citra resonansi magnetik atau “magnetic resonance imaging” (MRI). MRI merupakan peralatan yang digunakan dalam fasilitas medis.
Helium berada di bagian atas kelompok gas mulia dalam tabel periodik dengan simbol unsur He. Nomor atom helium adalah 2, massa helium 4,00260. Pada suhu kamar helium berfase gas dengan nilai kepadatan 0,1786 g/L, Titik leleh -272,20 C, -457,96 F, dan Titik didih -268,93 C, -452,07 F. Jari-jari atom helium sangat kecil, sekitar 0,2 nanometer.
Dari mana asalnya gas Helium?
Helium hadir sangat sedikit di atmosfer bumi, karena gravitasi bumi tidak bisa menahan unsur ini. Ketika helium ada di permukaan bumi, helium akan segera naik ke atmosfer dan akan terbebaskan keluar dari bumi. Inilah penyebab apabila gas helium dimasukan dalam balon maka balon akan terangkat ke udara.
Helium yang diproduksi secara komersial diperoleh dari bawah permukaan. Beberapa lapangan (fields) gas alam memiliki cukup helium yang bercampur dengan gas lainnya yang dapat diekstraksi dengan biaya ekonomis. Di Amerika Serikat, beberapa lapangan gas alam mengandung lebih dari 7% helium dari total volume gas yang ada. Perusahaan yang mengebor gas alam di daerah ini menghasilkan gas alam dan memproses helium sebagai produk sampingan.