
بِسْــــــــــــــــــمِ اللهِ الرَّحْمَنِ الرَّحِيْمِ
Assalamualaikum w.r.b. teman-teman 😉
Slamat datang di bisakimia.com insyaallah pasti bisa 🙂
perlu diketahui ya gaes, selain Reaksi REDOKS ada juga loh reaksi AUTO REDOKS apasih reaksi auto redoks itu ? yuk langsung saja simak penjelasan singkat berikut. Selamat belajar dan keep spririt yak :)))))
- Reaksi auto redoks atau disproporsional adalah reaksi redoks yang oksidator dan reduktornya merupakan zat yang sama . jadi, sebagian dari zat itu mengalami oksidasi dan sebagiannya lagi mengalami reduksi .
- Okidator (pengoksidasi) adalah zat yang mengoksidasi zat lain dalam suatu reaksi redoks , jadi, oksidator adalah zat yang mengalami reduksi
- Reduktor (pereduksi) adalah zat yang mereduksi zat laindalam suatu reaksi redoks . jadi, reduktor adalah zat yang mengalami oksidasi
- Contoh reaksi autoredoks:
Contoh 01
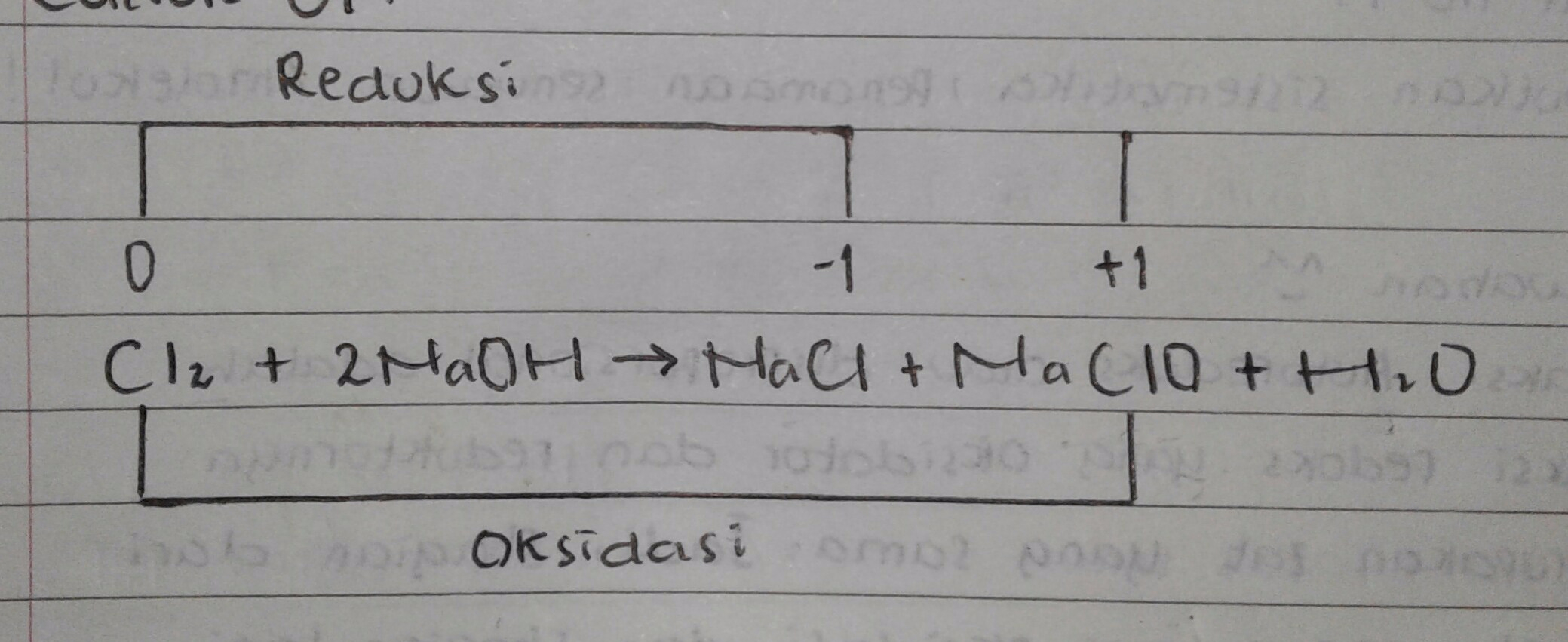
Sebagian dari gas klorin (CI2) (Biloks=0) Mengalami redoks menjadi NaCI (Biloks= -1) dan sebagian lagi mengalami Oksidasi menjadi NaCI0 (Biloks= +1)
Contoh 02

Contoh 03
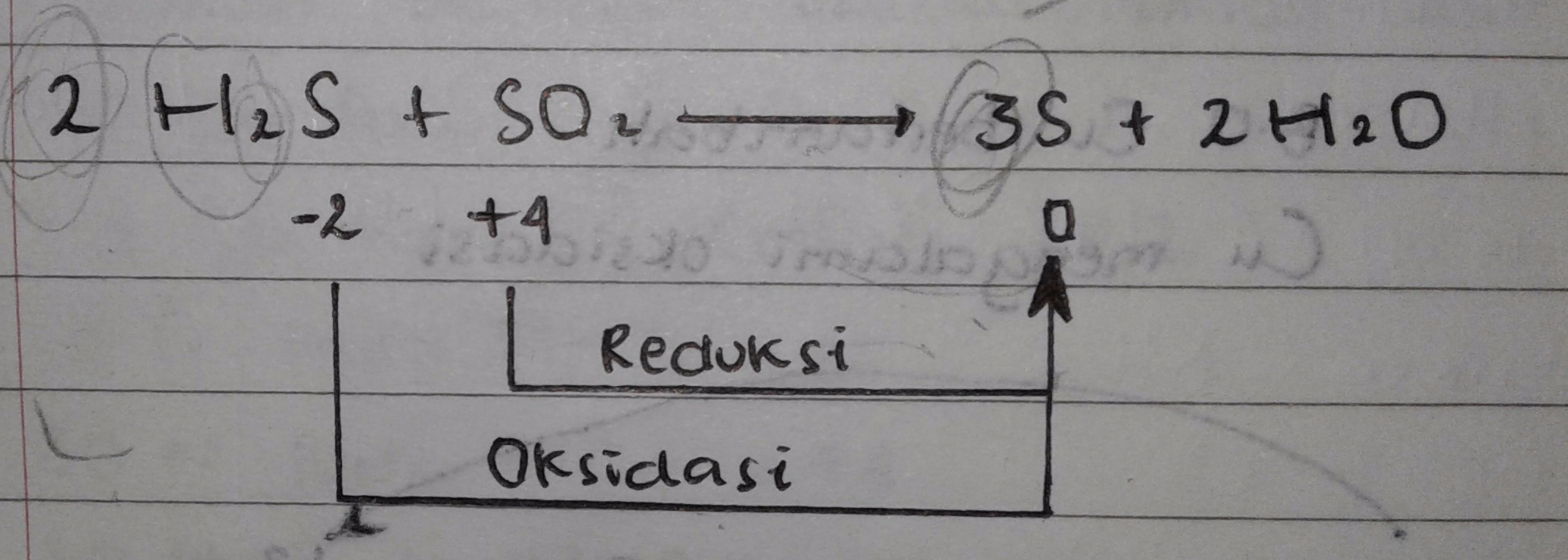
Reaksi diatas termasuk reaksi auto redoks karna pada reaksi terrsebut H2S berfungsi sebagai reduktor sedangkan SO2 berfungsi sebagai oksidator.
Contoh 04
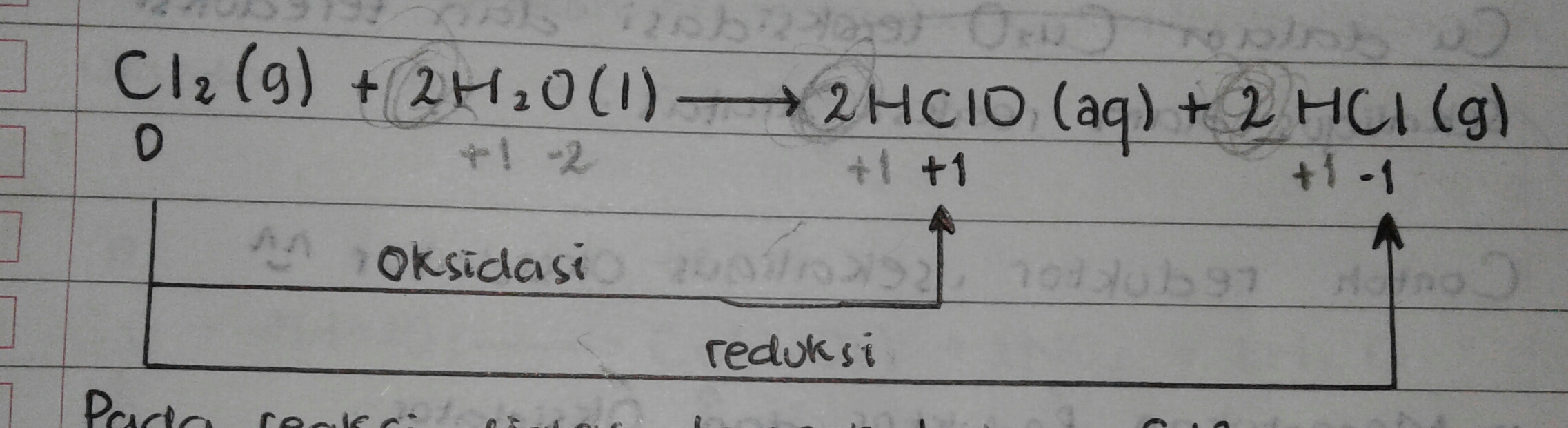
Pada reaksi diatas, tampak bahwa Cl2 mengalami Oksidasi menjadi HCIO dan mengalami reduksi menjadi HCI. Hal ini berarti Cl2 berperan sebagai oksidator. Dengan demikian reaksi tersebut termasuk reaksi autoredoks.
Contoh 05

Cu dalam Cu2O teroksidasi dan tereduksi sekaligus dalam reaksi diatas
- Contoh menentukan Reduktor dan Oksidator
contoh 01
Cu + 4NHO3 → Cu(NO3)2 + 2NO2 + 2H2O
tentukan bilangan oksidasi unsur – unsur terlebih dahulu
BO Cu pada Cu = 0
BO Cu pada Cu(NO3)2 = +2
BO N pada HNO3 = +5
BO N pada NO2 = +4
BO H pada HNO3 = +1
BO H pada H2O = +1
BO O pada HNO3 , Cu(NO3)2, 2NO2 dan 2H2O = +2
Dari hasil diatas terlihat bahwa hanya Cu dan N yang mengalami perubahan biloks . Cu mengalami kenaikan biloks dari 0 menjadi +2 , sedangkan N mengalami penurunan biloks dari +5 menjadi +4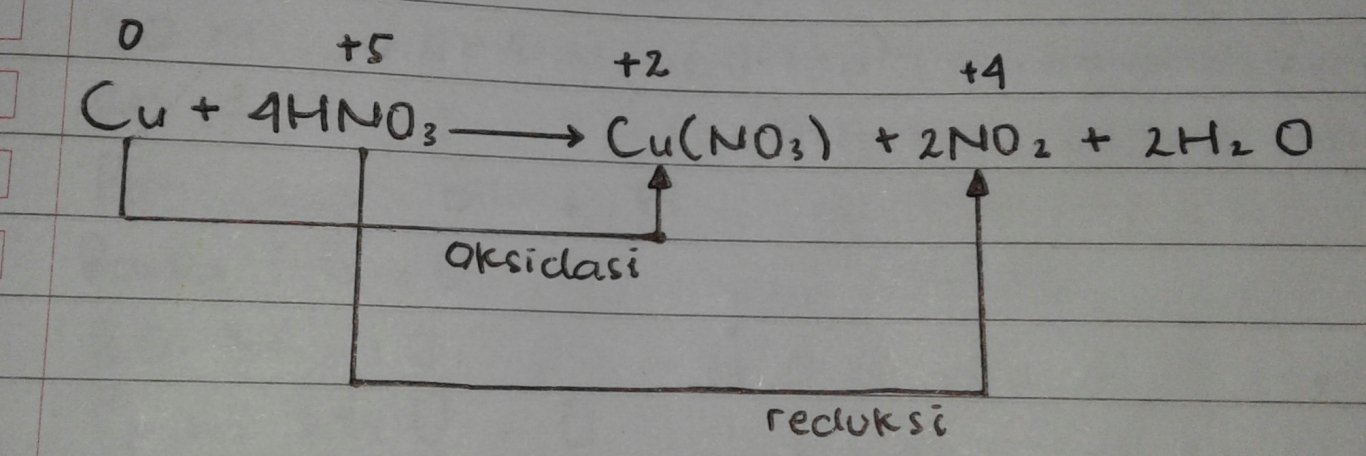
Dengan begitu diperoleh ;
oksidator = biloks turun =mengalami reduksi = HNO3
reduktor = biloks naik = mengalami oksidasi = Cu
Hasil oksidasi = Cu(NO3)2
hasil reduksi = NO2
contoh 02

Dengan begitu diperoleh ;
oksidator = biloks turun =mengalami reduksi = 2HCl
reduktor = biloks naik = mengalami oksidasi = Fe
Hasil oksidasi = FeCl2
hasil reduksi = H2
contoh 03
Mg + 6HNO3 + 7H2 → Mg(NO3)2 + 2NH4NO3 + 6H2O
Mari tentukan bilangan oksidasi unsur – unsur terlebih dahulu!
- perubahan biloks Mg
BO Mg = 0
BO Mg(NO3)2 → Mg+2 + NO3
biloks Mg = +2 , N = +5 , O = -2
- perubahan biloks N
pada HNO3 → H+ + NO3–
BO H = +1 , N = +5 , O = -2
Pada NH4NO3 → NH4 + NO3–
Dari NH4+ = +1
BO N + 4 × BOH= +1
BO N + 4 (+1) = +1
BO N + 4 = +1
BO N = +1 – 4
BO N = -3
- perubahan biloks H
pada H2 = 0
BO H = 0
pada H2O = 0
BO H = +1 dan 0 = -2
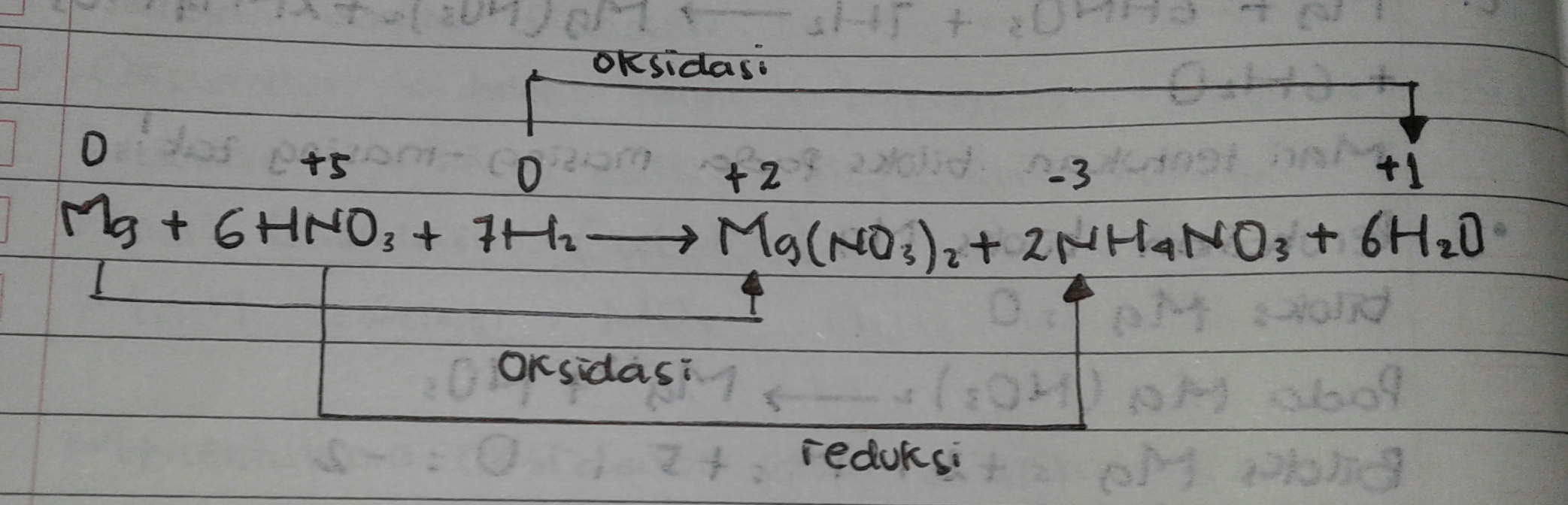
dari penjabaran diatas , hanya H , Mg , dan N yang mengalami perubahan biloks .
Mg naik dari 0 menjadi +2
H naik dari 0 menjadi + 1 dan
N turun dari +5 menjadi -3
maka diperoleh ;
- oksidator = niloks turun = mengalami reduksi = =N
- reduktor = biloks naik = mengalami oksidasi = Mg dan H2
- Hasil oksidasi = Mg(NO3) dan H2O
- HAsil reduksi = NH4NO3
contoh 04
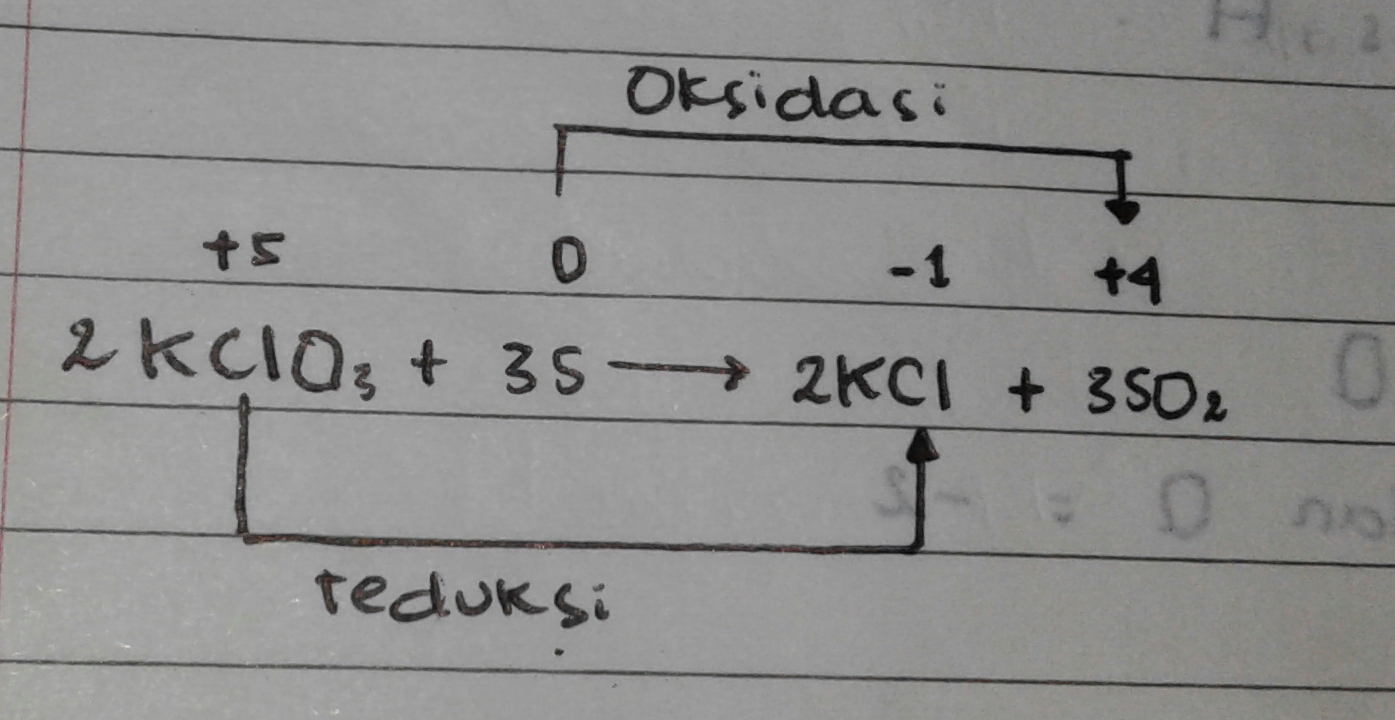
Biloks S naik dari O (pada 3S) menjadi +4 (pada KCl)
Biloks Cl turun dari +5 (pada KClO3) menjadi -1 (pada KCl)
- oksidator = biloks turun = mengalami reduksi = KClO3
- reduktor = biloks naik = mengalami oksidasi = S
- Hasil oksidai = 3SO2
contoh 05

biloks Cu turun dari +2 (pada CuSO4) menjadi +1 ( pada CuI)
biloks I naik dari -1 (pada KI) menjadi 0 (pada I2)
- oksidator = biloks turun = mengalami reduksi = CuSO4
- Reduktor = biloks naik = mengalami oksidasi = KI
- Hasil oksidasi = I2
- Hasil reduksi = CuI
okedeh segitu dulu ya yang bisa saya share. Semoga membantu belajar kalian, ingat kalau udah bisa ntar kimia itu bakal buat ketagihan kok 🙂
semoga allah senantiasa menambhkan ilmu beserta kefahamanNya buat kita yah 🙂
see yoou latter semuaaa … wassalamualaikum w.r.b




terima kasih yaa….
Siap sama sama
apanya definisi autoreedok. adapa definisi zat sebagai reduktor dan zat swbagai oksidator.kenapa bisa Konproporsinasi termasuk auto redoks
Terima kasih banyak ya gan. Semoga ilmu yang anda berikan dapat menjadi amal jariyah yang tiada putus putusnya Aamiinnn….