Pendahuluan
Tidak lama setelah ditemukannya senyawa alkil logam transisi, maka semakin jelaslah bahwa kehadiran logam transisi pada kelompok alkil belum pernah terjadi sebelumnya dalam kimia organik sederhana. Misalnya, terjadinya proses α-eliminasi reversibel dan kemampuan untuk mengekstrak hidrida dari karbon β-senyawa logam transisi-etil adalah dua contoh sederhana dari dampak logam transisi pada gugus alkil.
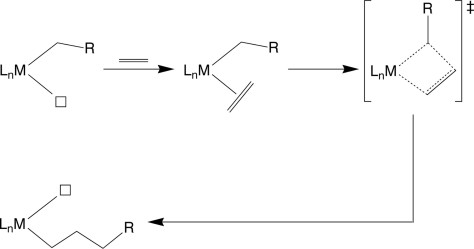
Selanjutnya, pada metode penentuan struktur kristal tunggal, ditemukan adanya ikatan C–H di mana pada atom hidrogennya berinteraksi sangat dekat dengan logam pusatnya, seperti pada gambar di bawah ini.
Namun, pada studi mengunakan difraksi x-ray, metode ini tidak menjelaskan adanya pendekatan hidrogen dengan logam, tidak ada bukti yang dapat membedakan apakah metode tersebut dapat merefleksikan interaksi antara ikatan C–H dengan logam atau struktur ligan yang berikatan dengan C–H.
Untuk menjelaskan hal tersebut maka dilakukan percobaan dengan menggunakan senyawa Titanium (Me2PCH2CH2PMe2) TiEtCl3 yang telah dipreparasi dan dikarakterisasi dengan x-ray seperti pada gambar di bawah ini.
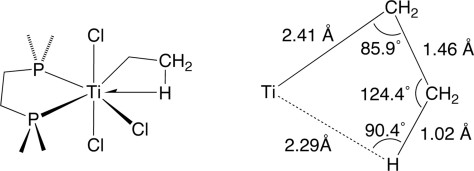
(Me2PCH2CH2PMe2) TiEtCl3 dipilih sebagai senyawa target dengan alasan sebagai berikut :
-
Orbital logam pusat Titanium d0 sehingga terdapat orbital d kosong yang bersedia untuk menerima densitas elektron dari ikatan C—H
-
Ligan relatif kecil dan tidak sterik sehingga tidak dapat menghambat pendekatan ikatan C–H
-
Etil dapat memecahkan simetri ikatan Ti—C sehingga identifikasi interaksi Ti-H-C lebih mudah
Struktur kristal (Me2PCH2CH2PMe2) TiEtCl3 menunjukkan sudut yang sangat akut 85,9 (6) ° pada karbon β yang mendekati sudut normal yaitu sebesar 109° sesuai dengan yang diharapkan. Hasil ini memberikan bukti pertama yang tak meragukan bahwa jarak pendek H–Ti dan sudut akut harus timbul dari gaya tarik antara pusat titanium dan C–H obligasi.
Berdasarkan data difraksi netron, panjang ikatan C-H dan M-H 5-20% lebih panjang daripada ikatan logam hidrida dan hidrokarbon pada umumnya. Panjang ikat antara logam dengan hidrogen umumnya adalah 1,8 – 2,3 Ǻ, dan sudut M-H-C berkisar antara 90 – 140°. Sedangkan jika menggunakan instrumen 1H NMR, akan terlihat dari hidrogen aril atau alkana yang bergeser ke medan atas (upfield) yang menandakan keberadaan ligan hidrida.
Sejarah
kata agostik yang berarti “untuk tetap dekat dengan sesuatu” pertama digunakan dalam bidang kimia oleh Maurice Brookhart dan Malcolm Green untuk menggambarkan interaksi antara logam transisi dengan ikatan karbon-hidrogen.Umumnya, interaksi agostik melibatkan gugus alkil ataupun aril yang berada dekat dengan pusat logam melalui ikatan sigma tambahan
Definisi asli : “ merujuk secara spesifik kepada kondisi dimana atom hidrogen berikatan kovalen sekaligus pada karbon dan atom logam transisi” Brookhart,M: Green. M. L. H. J. Organometall. Chem. 1983, 250, 395
Definisi diperbarui : ”Distorsi dari senyawa organometal yang membawa C-H pada kedekatannya dengan logam pusat” Scherer, W.: McGrady, G. S. Angrew. Chem., Int. Ed. Engl. 2004,43,1782
Interaksi Agostik
Interaksi agostik adalah interaksi karbon dengan hidrogen dalam gugus alkil sederhana yang dikenal dalam kimia oganik sebagai ikatan yang stabil dan inert. Interaksi agostik dapat digunakan secara spesifik untuk menjelaskan berbagai manifestasi interaksi kovalen antara karbon-hidrogen dan pusat logam transisi dalam senyawa organologam untuk situasi di mana atom hidrogen kovalen terikat secara bersamaan untuk kedua atom karbon dan atom logam transisi. Perilaku yang ditujukannya dengan pusat logam transisi jelas memiliki relevansi yang cukup untuk kimia organologam dan khususnya pada reaksi katalitik organologam.
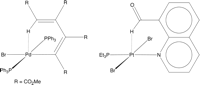
Pada mulanya ikatan C—H–M agostik diangap sama dengan sistem bridging pada atom hidrogen yag terjadi pada molekul B–H—B, M—H—M, dan B–H–M. Namun pada interaksi yang terakhir, contohnya pada ikatan 3-pusat -2-elektron, ternyata tidak memenuhi aturan. Berdasarkan definisi senyawa agostik, ditekankan bahwa tidak semua senyawa yang memiliki sruktur M—H–C diklasifikasikan sebagai senyawa denganyang berinteraksi agostik. Seiring dengan berkembangnya ilmu pengetahuan,  bentuk molekul M—H—C tidak tepat digambarkan sebagai senyawa 3-pusat-2-elektron, oleh karenanya molekul ini tidak harus diklasifikasikan sebagai senyawa degan interaksi agostik. Gagasan ini pertama kali diajukan oleh Brammer, yang menganalisis kompleks dengan interaksi M–H-N dan perubahan panjang linier M–H-N paling baik digambarkan sebagai ikatan hidrogen yang melibatkan interaksi orbital 3-pusat-4-elektron da kontribusi elektrostatik di mana logam berfungsi sebagai akseptor ikatan hidrogen. Contoh sederhananya adalah kompleks M –H-N ikatan hidrogen disediakan oleh [Et3NH] [Co (CO) 4]. Pada kompleks ini, [Co (CO) 4] – anionnya memiliki konfigurasi 18– elektron dan tidak memiliki orbital kosong pada kulit valensi, contohnya logam yang tidak mampu berikatan dalam 3-center-2-elektron interaksi M—H-N. C–H groups diketahui merupakan donor ikatan hidrogen yang lemah. Oleh karena itu, Brammer kemudian meningkatkan kemungkinan bahwa beberapa M–H-C interaksi lebih baik digambarkan sebagai ikatan hidrogen daripada interaksi agostik, contohnya pada senyawa trans-Pd (PPh3) 2 {C4 (CO2Me) 4H} Br. Interaksi M—H-C yang tidak melibatkan 3-pusat-2-elektron ini disebut interaksi anagostik.
bentuk molekul M—H—C tidak tepat digambarkan sebagai senyawa 3-pusat-2-elektron, oleh karenanya molekul ini tidak harus diklasifikasikan sebagai senyawa degan interaksi agostik. Gagasan ini pertama kali diajukan oleh Brammer, yang menganalisis kompleks dengan interaksi M–H-N dan perubahan panjang linier M–H-N paling baik digambarkan sebagai ikatan hidrogen yang melibatkan interaksi orbital 3-pusat-4-elektron da kontribusi elektrostatik di mana logam berfungsi sebagai akseptor ikatan hidrogen. Contoh sederhananya adalah kompleks M –H-N ikatan hidrogen disediakan oleh [Et3NH] [Co (CO) 4]. Pada kompleks ini, [Co (CO) 4] – anionnya memiliki konfigurasi 18– elektron dan tidak memiliki orbital kosong pada kulit valensi, contohnya logam yang tidak mampu berikatan dalam 3-center-2-elektron interaksi M—H-N. C–H groups diketahui merupakan donor ikatan hidrogen yang lemah. Oleh karena itu, Brammer kemudian meningkatkan kemungkinan bahwa beberapa M–H-C interaksi lebih baik digambarkan sebagai ikatan hidrogen daripada interaksi agostik, contohnya pada senyawa trans-Pd (PPh3) 2 {C4 (CO2Me) 4H} Br. Interaksi M—H-C yang tidak melibatkan 3-pusat-2-elektron ini disebut interaksi anagostik.
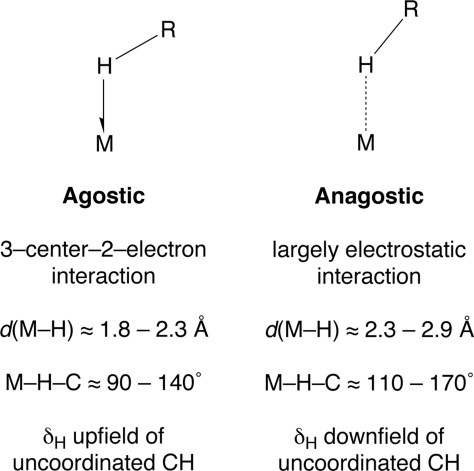
Interaksi Agostik dan anagostik M–H-C berbeda secara signifikan setelah dikarakterisasi berdasarkan sifat struktual dan spektroskopisnya. Interaksi agostik M–H-C ditandai dengan jarak M–H yang relatif pendek (≈ 1,8-2,3 Å) dan sudut ikatan kecil M—H-C (≈ 90-140 °), sedangkan pada interaksi anagostik ditandai dengan jarak M–H yang relatif panjang (≈ 2,3-2,9 Å) dan sudut ikatan yang terbentuk cukup besar M—H-C (≈ 110-170 °). Berdasarkan dengan 1H NMR spektroskopi, nilai dari interaksi agostik sangatlah rendah yaiyu berkisar antar 50-100 Hz. Selain itu, pergeseran kimia dari atom hidrogen pada interaksi agostik agostik biasanya diamati dari upfield dari kelompok terkoordinasi, sedangkan atom hidrogen pada interaksi anagostik biasanya diamati dari downfield-nya.
Faktor yang Mempengaruhi Interaksi Agostik
Interaksi M–H-C agostik melibatkan donasi densitas elektron terkait dengan ikatan C–H ke pusat logam yang memiliki ≤ 16-elektron konfigurasi. Pada pusat logam yang orbitalnya tidak d0, interaksi juga dilengkapi dengan backbonding ke C-H orbital σ *.Oleh karena itu, kemampuan untuk mengisolasi senyawa agostik sangatlh bergantung pada besarnya interaksi ini. Dengan demikian, jika σ-sumbangan terlalu lemah, interaksi agostik tidak akan terjadi, sebaliknya jika interaksi backbonding terlalu kuat dapat terjadi pemutusan ikatan C—H yang mengakibatkan pembentukan turunan alkil-hidrida.
Peran Interaksi Agostik
Peranan interaksi agostik adalah untuk menstabilkan reaksi tak jenuh pada fasa intermedietnya dan untuk menentukan struktur pada keadaan transisinya. Bukti bahwa interaksi agostik adalah berdasarkan pada pengamatan langsung fasa intermediet pada suhu rendah dengan teknik spektroskopi atau melalui H / D efek isotop. Contoh bahwa interaksi agostik berperan penting dalam fasa intermediet maupun adalah pada penyisipan
olefin pada kedua transisi awal dan akhir logam hidrogen dan ikatan karbon serta bagaimana interaksi tersebut diusulkan untuk mengendalikan stereokimia polimer yang dihasilkan melalui koordinasi / penyisipan propagasi rantai.