
Menentukan Bilangan Saponifikasi/Penyabunan Dengan Titrasi Asam Basa
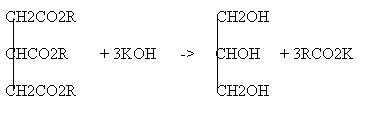
Bilangan saponifikasi didefinisikan sebagai milligram KOH yang diperlukan untuk menitrasi 1 gram lemak dengan reaksi:
0,10 gram mentega dititrasi dengan menggunakan 25 mL KOH 0,250 N. Setelah proses saponifikasi berlangsung sempurna maka KOH yang tidak bereaksi dengan mentega dititrasi dengan 0,250 N HCl dan membutuhkan 9,26 mL. Berapakah bilangan saponifikasi/bilanga penyabunan dari mentega tersebut? Dan hitung pula berapa berat formula lemak dalam mentega tersebut (asumsikan semua mentega adalah lemak).
Jawab:
Metode titrasi diatas sering dilakukan pada industri minyak goreng dan sabun. Hal ini penting untuk mengetahui jumlah total lemak dan asam lemak dalam minyak. Titrasi yang dipakai adalah titrasi kembali, jadi KOH awal adalah berlebih dan kelebihan KOH yang tidak bereaksi dengan lemak dititrasi dengan HCl menggunakan indicator pp.
Jumlah mol KOH awal dikurangi mol KOH yang bereaksi dengan KOH adalah jumlah mol KOH yang bereaksi dengan lemak. Keseluruhan reaksi dapat ditulis:
HCl + KOH -> KCl + H2O
Mol-eq KOH awal
= V.N
= 25 mL x 0,25 N
= 6,25 mmol-eq
= 6,25 mmol
Mol KOH yang bereaksi dengan HCl diperoleh:
= V.N HCl
= 0,25 mL x 9,25 mL
= 2,3125 mmol-eq
= 2,3125 mmol
Jadi mol KOH yang bereaksi dengan lema adalah
= 6,25 mmol – 2,3125 mmol
= 3,9375 mmol
Massa KOH
= mole x Mr
= 3,9375 x 56
= 220,5 mg
Bilangan saponifikasi/penyabunan didefinisikan sebagai mg KOH yang bereaksi dengan 1 gram lmak. Dari perhitungan diatas 220,5 mg KOH bereaksi dengan 1,10 g lemak jadi bilangan saponifikasinya:
= 1 g/ 110 g x 220,5 mg
= 200,5 mg
Jadi cara membaca bilanga diatas adalah: setiap gram lemak akan bereaksi dengan 200,5 mg KOH.
Untuk mencari berat formula lemak maka tinggal membagi massa lemak dengan molnya sehingga diperoleh:
Mol lemak (diperoleh dari reaksi diatas)
= 1/3 x mol KOH
= 1/3 x 3,9375 mmol
= 1,3125 mmol
Dan berat formula lemak
= 1,10/ 1,3125.10-3
= 838,1 gram/mol
Jadi dari prhitungan diatas bilangan saponifikasi mentega diatas adalah 200,5 dan berat formula lemaknya adalah 838,1 gram/mol.
Menghitung Volume H2SO4 Yang Dibutuhkan Untuk Titrasi Dengan LiOH
Berapa volume 0,310 N H2SO4 yang dibutuhkan untuk menitrasi 0,293 g LiOH yang memiliki kemurnian 90%?
Jawab:
Ini adalah contoh soal titrasi asam basa. H2SO4 sebagai asam dan LiOH sebagai basa. Soal ditrasi seperti ini dengan mudah dapat diselesaikan dengan menggunakan rumus VN asam = VN basa. Dan reaksinya:
2LiOH + H2SO4 à Li2SO4 + 2H2O
Massa 90% LiOH yang sebenarnya dalam 0,293 g adalah
= 90% x 0,293 g
= 0,2637 g
Mol LiOH
= massa/Mr
= 0,2637 / 24
= 0,0122 mol
Dan mole ekuivalen LiOH adalah
= 0,0122 x 1
= 0,0122 mol-eq
Pada saat titik ekuivalen maka mol-eq H2SO4 akan sama dengan mol-eq LiOH shingga:
Mol-eq H2SO4 = mol-eq LiOH
V x N = 0,0122 mol-eq
V x 0,310 = 0,0122
V = 0,0394 L = 39,4 mL
Jadi volum 0,310 N H2SO4 yang dibutuhkan adalah 39,4 mL
Menghitung Prosentase KH2PO4 Dengan Titrasi Asam Basa
Suatu sample 0,492 g KH2PO4 dititrasi dengan menggunakan 0,112 N NaOH dan membutuhkan 25,6 mL. Hitunglah prosentase kemurnian KH2PO4 jika reaksi yang terjadi adalah:
KH2PO4 + NaOH à KNaHPO4 + H2O
Jawab:
Untuk perhitungan titrasi maka kita dapat menggunakan rumus VN asam = VN basa. Karena VxN adalah sama dengan mol-ekuivaln maka pada waktu titik ekuivalen terjadi maka mol-eq asam sama dengan mol-eq basa, sehingga:
mol-eq KH2PO4 = mol-eq NaOH
mol-eq KH2PO4 = 0,112 N x 25,6 mL
mol-eq KH2PO4 = 2,8672 mmol-eq
dari reaksi diatas KH2PO4 melpas 1 H+ untuk bereaksi dengan NaOH maka kita harus mengubahnya dari mmol-eq mnjadi mmol
mole KH2PO4 = mmol-eq /1 = 2,8672 mmol-eq/1 = 2,8672 mmol
massa KH2PO4
= mole x Mr
= 2,8672 x 136
= 389,94 mg
Prosentase H2PO4 dihitung sebagai berikut:
= 389,94 mg / 492 mg x 100%
= 79,26%
Jadi prosentase KH2PO4 dari sample tersebut adalah 79,26%




maaf gan, bukannya KH2PO4 itu n=2, kok di sini n=1 kenapa? mohon dijelaskan