
I. HUKUM DASAR ILMU KIMIA
a. Hukum Kekekalan Massa (Hukum Lavoisier)
“Massa zat sebelum dan sesudah reaksi adalah sama”.
Contoh:
S + O 2 → SO 2
32 gr 32 gr 64 gr
b. Hukum Perbandingan Tetap (Hukum Proust)
“Perbandingan massa unsur dalam tiap senyawa adalah tetap”
Contoh:
H 2 O → massa H : massa O = 2 : 16 = 1 : 8
c. Hukum Perbandingan Berganda (Hukum Dalton)
“Jika dua unsur dapat membentuk dua senyawa atau lebih, dan massa salah satu unsur sama, perbandingan massa unsur kedua berbanding sebagai bilangan bulat dan sederhana”.
Contoh:
– Unsur N dan O dapat membentuk senyawa NO dan NO 2
– Dalam senyawa NO, massa N = massa O = 14 : 16
– Dalam senyawa NO 2 , massa N = massa O = 14 : 32
– Perbandingan massa N pada NO dan NO 2 sama maka
perbandingan massa O = 16 : 32 = 1 : 2
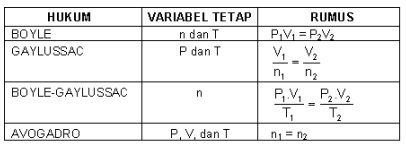
d. Hukum Gas Ideal
Untuk gas ideal atau suatu gas yang dianggap ideal berlaku rumus :
PV = n RT
Keterangan:
P = tekanan (atmosfir)
V = volume (liter)
n = mol = gram/Mr
R = tetapan gas (lt.atm/mol.K)
T = suhu (Kelvin)
Dari rumus tersebut dapat diperoleh :
II. MASSA ATOM RELATIF DAN MASSA MOLEKUL RELATIF
III. KONSEP MOL
a. Dalam ilmu kimia satuan jumlah yang digunakan adalah mol
b. satu mol adalah sejumlah zat yang mengandung 6,02 x 10^23 partikel
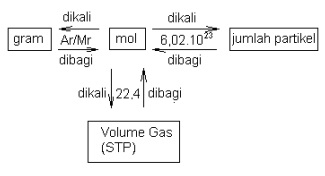
Hubungan Mol dengan jumlah partikel
Jumlah Partikel = mol x 6,02 x 10^23
mol = Jumlah partikel / 6,02 x 10^23
Hubungan Mol dengan Massa
Untuk unsur :
- mol = gram / Ar
- gram = mol x Ar
Untuk senyawa :
- mol = gram/Mr
- gram = mol x Mr
Hubungan Mol dengan Volume Gas
Setiap satu mol gas apa saja keadaan standard (0oC, 1 atm) mempunyai volume : 22, 4 liter.
- Volume gas = mol x 22,4
- mol = Volume / 22,4
Hubungan mol, jumlah partikel dan hubungan gas dapat digambarkan dalam bentuk
diagram sebagai berikut :
2 Poin terakhir silahkan lanjut ke halaman berikutnya ya





Terimakasih, rangkumannya sangat membantu 🙂
Iya sama sama 🙂
[…] Klik untuk mencetak(Membuka di jendela yang baru) […]
terima kasih, ini menjadi referensi saya. semoga berkenan berkunjung balik, rangkuman materi perkuliahan saya http://jendeladunia-mu.blogspot.co.id/
maaf sebelumnya, itu volume saat 1 atm kok mol x 22.5 L??
yang halaman kedua
[…] https://bisakimia.com/2015/01/23/rangkuman-materi-stoikiometri/ […]
Mantap Sangat Bermanfaat.
Tambahan Referensi
Maaf om, coba kasih linknya saat pas isi data aja. Jgn di komennya 🙂
Masukan buat admin, seharusnya tidak memakai istilah berat ya tetapi gunakan istilah massa sehingga massa=mol x Ar atau Mr.
Berat dan massa definisinya tentu berbeda ya min hehe
Beberapa artikel saya temui kekeliruan seperti ini ^^
Hmmm kaya kenal gambar tulisan “stoichiometry”nya…..
Kalo saya sih gak bisa apa apa. sip keren adminnya
haha sip makasih gan
massa zat sebelum dan sesudah reaksi sama , tp di atas pada contoh ga sama gan
Terimakasih koreksinya sepertinya itu salah ketik. Seharusnya 32. Tapi hanya terketik 2 saja. Saya update dlu