Konsep Mol
HCl adalah sebuah rumus kimia asam klorida yang dibentuk dari atom hidrogen dan atom Cl dengan jumlah yang sama misalnya 2000 H memerlukan 2000 Cl.
Mol adalah satuan yang digunakan dalam ilmu kimia untuk menyatakan jumlah zat dalam gram yang ditimbang supaya zat itu mengandung partikel yang jumlahnya sama
Sebagai standar mol dipilih isotop karbon 12 yang massanya 12 gram. Jumlah atom karbon yang terdapat dalam 12 gram 12C ialah suatu bilangan yang sangat besar yang disebut bilangan avogadro yang diberi lambang N. Bilangan avogadro dapat diukur, bilangan itu letaknya antara 6,02224 x 1023 dan 6,02280 x 1023 dapat dibulatkan menjadi 6,02 x 1023 atau N
Satu mol zat adalah banyaknya zat itu yang mengandung N partikel (atom, molekul, ion) atau gabungan partikel yang dinyatakan dalam rumus kimia zat itu
misalnya :
- satu mol Fe mengandung N atom Fe
- satu mol H2 mengandung N molekul H2
- satu mol H2O mengandung N molekul H2O
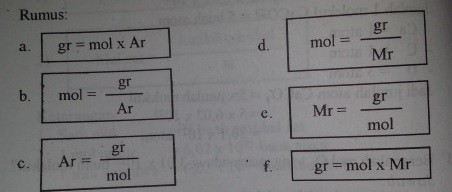
Rumus:
- Jumlah Partikel = mol x N
- mol zat = jumlan partikel / N
Massa Molar
Massa Molar adalah massa 1 mol sebanyak atom relatif unsur (Ar) atau massa molekul relatif (Mr) senyawa
misalnya :
1 mol 12C = 12 gram = 1 x Ar x 12C gram
1 mol 12C = 12 gram = 1 x Ar x 12C gram
1 mol 12C = 12 gram = 1 x Ar x 12C gram
Volume Molar
Berdasarkan hasil eksperimen diketahui bahwa 1 liter gas oksigen, O2 pada 0oC dan 76cm Hg (1 atm) menurut perhitungan adalah 32/1,429 liter = 22,4 liter. Jadi volume 1 mol sembarang gas pada 0oC dan 76 cm Hg adalah 22,4 L
Rumus:
Mol gas X = Volume X / 22,4
Volume gas X = mol x 22,4




[…] i […]