Tujuan
- Mempelajari kelarutan timbal balik antara dua cairan
- Menggambarkan hubungan antara kelarutan tersebut dengan temperatur dalam sebuah diagram fasa
Teori Dasar
Kita mengenal keadaan jenuh, hingga muncul pengertian “kelarutan”. Kelarutan dapat besar, sedang atau kecil bergantungpada jenis pelarut dan temperatur. Secara mikroskopik kita hanya dapat mengamati dua kemungkinan bila dua cairan dicampurkan, yaitu terjadi satu fasa atau terjadi 2 fasa. Pertama bila kelarutan timbal balik antara cairan pertama dan cairan kedua belum terlampaui. Kedua bila salah satu kelarutan antara kedua campuran tersebut telah terlampaui. Kedua kemungkinan itu dapat diterangkan secara termodinamik. Bila zat-1 terlarut dalam zat-2. Dengan anggapan larutan ideal maka potensial kimia komponen-2 dapat dinyatakan sebagai:
μ1 = μo1 + RT ln X1
dengan μo1, potensial kimia zat-1 murni, X1, fraksi mol zat-1
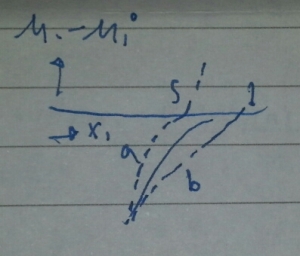 Kurva aliran μ1 – μ01 terhadap X1 tertera pada gambar. garis utuh adalah kurva larutan ideal. Garis a dan b menggambarkan kurva larutan nyata dengan penyimpangan negatif dari larutan ideal. Pada kurva larutan ideal dan garis b, potensial kimia komponen-1 selalu lebih rendah dibandingkan dengan potensial kimia zat-1 murni. Hal ini menunjukkan bahwa bila dalam larutan masih ada fasa zat-1 murni. Maka fasa ini akan berpindah ke fasa larutan dan larut sempurna. Kurva s menunjukkan bahwa bila fraksi mol zat-1 kurang dari suatu harga tertentu(s). Potensial kimia komponen-1 lebih rendah dari potensial kimia zat-1 murni, berarti proses kelarutan masih dapat berlangsung.
Kurva aliran μ1 – μ01 terhadap X1 tertera pada gambar. garis utuh adalah kurva larutan ideal. Garis a dan b menggambarkan kurva larutan nyata dengan penyimpangan negatif dari larutan ideal. Pada kurva larutan ideal dan garis b, potensial kimia komponen-1 selalu lebih rendah dibandingkan dengan potensial kimia zat-1 murni. Hal ini menunjukkan bahwa bila dalam larutan masih ada fasa zat-1 murni. Maka fasa ini akan berpindah ke fasa larutan dan larut sempurna. Kurva s menunjukkan bahwa bila fraksi mol zat-1 kurang dari suatu harga tertentu(s). Potensial kimia komponen-1 lebih rendah dari potensial kimia zat-1 murni, berarti proses kelarutan masih dapat berlangsung.
Alat dan Bahan
- Tabung reaksi sedang 8x
- Tabung reaksi besar 1x
- Gelas kimia 1 L 1x
- Pengaduk lingkar 1x
- Termometer
- Alat pembakar
- Statif, klem
- Fenol 20 gr
- Larutan NaCl 1% 6 mL
- Larutan CH3OH 1% 6mL
- Aquades
Cara Kerja
- Siapkan campuran fenol dengan air di dalam 8 buah tabung reaksi
- Panaskan tiap campuran dalam penangas air dengan susunan alatnya sesuai gambar. aduk, catat temperatur pada saat campuran berubah dari keruh menjadi jernih. Keluarkan tabung reaksi besar dari penangas air
- Bila penimbangan fenol pada pengerjaan 1 kurang teliti. Tentukan konsentrasi fenol dalam kedua fasa dengan larutan brom
- Buatlah dalam tabung reaksi sedng yang bersih. Campuran 4 gr fenol dengan 6 mL lar CH3OH 1%. Tentukan temperatur pada saat campuran berubah jadi jernih
Data Pengamatan
|
No |
Massa Fenol | Vol Air (mL) | T. Jenih (Co) | T. Keruh (Co) | T. Rata2 (Co) |
| 1 | 2 | 2 | 62 | 53 |
57,5 |
|
2 |
2 | 2,5 | 64 | 62 | 63 |
| 3 | 2 | 3 | 67 | 62 |
64,5 |
| 4 | 2 | 4 | 70 | 66 |
68 |
|
5 |
2 | 5 | 68 | 65 | 66,5 |
| 6 | 1 | 3,25 | 66 | 62 |
64 |
| 7 | 1 | 4,25 | 72 | 69 |
70,5 |
| 8 | 1 | 5,25 | 70 | 55 |
62,5 |
T Fenol + NaCl 1% C0| 73 | 71 |
T Fenol + Metanol C0| 68 | 63 |
Mr Fenol =94 gr/mol
Mr H2O = 18 gr/mol
Mr NaCl = 58,5 gr/mol
Mr CH3OH = 32 gr/mol
ρ H2O = 1 gr/mL
ρ NaCl = 2,165 gr/mL
ρ CH3OH = 0,791 gr/mL
Tabung 1
m H2O = ρ. V = 1 gr/mL . 2 mL = 2 gr
n H2O = 2 gr/(18 gr/mol) = 0,11 mol
n Fenol = gr/Mr = 2 gr/(94 gr/mol) = 0,021 mol
X fenol = 0,021 mol/(0,021 mol + 0,11 mol) = 0,16
Tabung 2
m H2O = ρ. V = 1 gr/mL . 2,5 mL = 2,5 gr
n H2O = 2,5 gr/(18 gr/mol) = 0,138 mol
n Fenol = gr/Mr = 2 gr/(94 gr/mol) = 0,021 mol
X fenol = n Fenol/n Total = 0,021 mol/0,159 mol = 0,32
Tabung 3
m H2O = ρ. V = 1 gr/mL . 3 mL = 3 gr
n H2O = 3 gr/(18 gr/mol) = 0,16 mol
n Fenol = gr/Mr = 2 gr/(94 gr/mol) = 0,021 mol
X fenol = n Fenol/n Total = 0,021 mol/0,181 mol = 0,116
Tabung 4
m H2O = ρ. V = 1 gr/mL . 4 mL = 4 gr
n H2O = 4 gr/(18 gr/mol) = 0,22 mol
n Fenol = gr/Mr = 2 gr/(94 gr/mol) = 0,021 mol
X fenol = n Fenol/n Total = 0,021 mol/0,241 mol = 0,087
Tabung 5
m H2O = ρ. V = 1 gr/mL . 5 mL = 5 gr
n H2O = 5 gr/(18 gr/mol) = 0,27 mol
n Fenol = gr/Mr = 2 gr/(94 gr/mol) = 0,021 mol
X fenol = n Fenol/n Total = 0,021 mol/0,291 mol = 0,72
Tabung 6
m H2O = ρ. V = 1 gr/mL . 3,25 mL = 3,25 gr
n H2O = 3,25 gr/(18 gr/mol) = 0,18 mol
n Fenol = gr/Mr = 1 gr/(94 gr/mol) = 0,01 mol
X fenol = n Fenol/n Total = 0,01 mol/0,181 mol = 0,055
Tabung 7
m H2O = ρ. V = 1 gr/mL . 4,25 mL = 4,25 gr
n H2O = 4,25 gr/(18 gr/mol) = 0,236 mol
n Fenol = gr/Mr = 1 gr/(94 gr/mol) = 0,01 mol
X fenol = n Fenol/n Total = 0,01 mol/0,237 mol = 0,042
Tabung 8
m H2O = ρ. V = 1 gr/mL . 5,25 mL = 5,25 gr
n H2O = 5,25 gr/(18 gr/mol) = 0,291 mol
n Fenol = gr/Mr = 1 gr/(94 gr/mol) = 0,01 mol
X fenol = n Fenol/n Total = 0,01 mol/0,291 mol = 0,034
Fenol + NaCl 1%
V NaCl 1% = 1% x V NaCl = 1% x 3 mL = 0,03 mL
m NaCl = ρ.V = 2,165 gr/mL . 0,03 mL = 0,0649 gr
mol NaCl = m/Mr = 0,0649 gr/(58,5 gr/mol) = 1,1 x 10-3 mol
V H2O = V NaCl Total – V NaCl 1% = 3 mL – 0,03 mL = 2,97 mL
m H2O = ρ. V = 1 gr/mL . 2,97 mL = 2,97 gr
n H2O = 2,97 gr/(18 gr/mol) = 0,165 mol
n Fenol = gr/Mr = 2 gr/(94 gr/mol) = 0,021 mol
X fenol = n Fenol/n Total = 0,021 mol/0,187 mol = 0,1123
Fenol + CH3OH 1%
V CH3OH 1% = 1% x V CH3OH = 1% x 3 mL = 0,03 mL
m CH3OH = ρ.V = 0,791 gr/mL . 0,03 mL = 0,02373 gr
mol CH3OH = m/Mr = 0,02373 gr/(32 gr/mol) = 7,4 x 10-4 mol
V H2O = V CH3OH – V CH3OH 1% = 3 mL – 0,03 mL = 2,97 mL
m H2O = ρ. V = 1 gr/mL . 2,97 mL = 2,97 gr
n H2O = 2,97 gr/(18 gr/mol) = 0,165 mol
n Fenol = gr/Mr = 2 gr/(94 gr/mol) = 0,021 mol
X fenol = n Fenol/n Total = 0,021 mol/0,1867 mol = 0,1125
Pembahasan
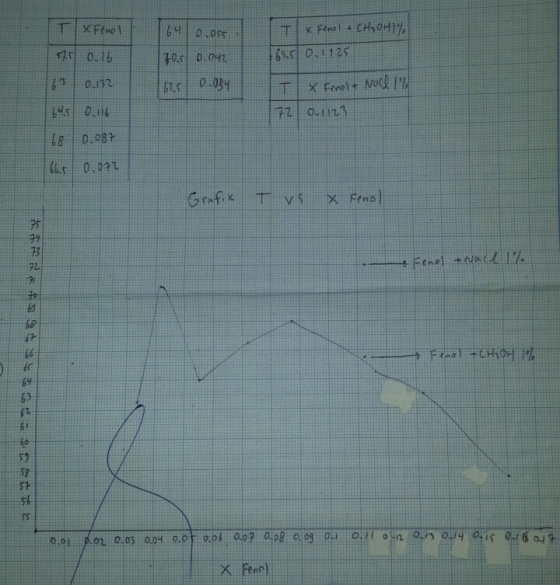
Pada percobaan kelarutan timbal balik ini. diawali dengan menyiapkan 8 campuran fenol – air dengan berbagai komposisi. Tiap campuran dipanaskan pada penangas air dan diaduk hingga jernih. saat inilah dilakukan pencatatan temperatur. Setelah itu campuran dikeluarkan dari penangas dan tunggu sampai terjadi perubahan fasa lagi menjadi keruh. catat lagi suhunya.
Berdasarkan percobaan yang telah dilakukan, dapat diketahui pengaruh suhu terhadap kelarutan suatu zat. Campuran Fenol – air pada suhu kamar tidak larut sempurna. Terlihat adanya dua fasa. fasa dimana fenol telah jenuh dengan air dan saat air telah jenuh dengan fenol. Namun saat dipanaskan, setelah mencapai suhu tertentu campuran akan menjadi bening, hal ni terjadi karena fenol telah telah larut sempurna dalam air. Kemudian dilakukan pendinginan yang dimaksudkan untuk mengetahui suhu saat campuran fenol dan air kembali menjadi 2 fasa.
Hal tersebut berkaitan dengan derajat kebebasan :
F = C – P + 2
Pada percobaan, tekanan diatur tetap dan mengakibatkan derajat kebebasab berubah. Persamaan menjadi
F = C – P + 1
Pada diagram, ditunjukkan adanya titik maksimum. Titik tersebut disebut titik konsulut ata yang merupakan batas atas temperatur saat terjadi pemisahan fasa
Adanya penambahan CH3OH dan NaCl pada prosedur dimaksudkan untuk melihat pengaruhnya terhadap kelarutan zat terlarut. CH3OH dapat menyebabkan efek salting in, yaitu bertambahnya kelarutan, hal ini terjadi karena adanya ikatan hidrogen yang terjadi antara CH3OH dan air. Sedangkan NaCl akan memberi pengaruh berlawanan. Yaitu efek salting out, yaitu berkurangnya kelarutan suatu zat karena adanya penambahan zat tertentu.
Kesimpulan
- Temperatur mempengaruhi kelarutan timbal balik
- CH3OH dapat memberi efek salting in
- NaCL dapat memberi efek salting out
- Kondisi dari percobaan mempengaruhi derajat kebebasan
Daftar Pustaka
- G.W. Castellan. Physical Chemistry Edisi kedua. 1971, hal 327 – 330
- A.W. Francis. Liquid Equilibriums. Interscience Publisher. NY,1963
- J.M. Wilson et.al. Experiments in Physical Chemistry, edisi kedua. Pergamon Dress. 1968. hal 47-48