Tujuan
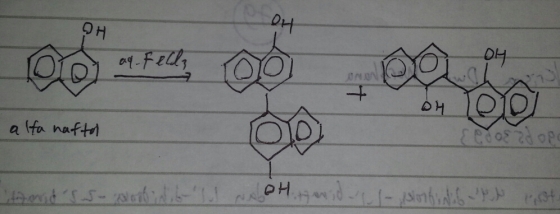
Mengetahui dan memahami Sintesis 4, 4′ – Dihidroksi -1, 1′ – Binaftil dan 2, 2′ – Dihidroksi – 2, 2′ binaftil melalui mekanisme oksidasi kopling
Teori Dasar
Reaksi yang terjadi dalam sintesis Sintesis 4, 4′ – Dihidroksi -1, 1′ – Binaftil dan 2, 2′ – Dihidroksi – 2, 2′ binaftil
Alat dan Bahan
- Labu bulat
- Kondensor / refluks
- Corong buchner
- Pemanas
- α – Naftol
- Larutan feriklorida
- Benzena
Cara Kerja
- Panaskan air. Larutkan 8gr
- α – Naftol dalam air mendidih 700 – 800 mL. Aduk sampai 80% tambah perlahan feriklorida 5% 160 mL. Aduk pada suhu 70 – 80C 5 menit
- Saring dengan buchner. Cuci α – Naftol dengan air panas
- Tambah benzena 30 mL. Reflux 5 menit. Saring, cuci dengan benzen panas
- Rekristalisasi dengan etanol – air (8:2)
- Hitung kristal
- Filtrat dimasukkan dalam wadah evaporasi putar. Amati sampai terbentuk pasta. Tambah benzena dingin 3 – 4 mL
- Hitung Produk
Pengamatan dan Pengolahan Data
Massa 4, 4′ – Dihidroksi -1, 1′ – Binaftil dan 2, 2′ – Dihidroksi – 2, 2′ binaftil
mol x Mr = 0,0139 mol x 286 gr/mol = 3,9754 gr
% Kesalahan Relatif = |(1,6 gr – 3,9754 gr) / 3,9754 gr )| x 100% = 59,75 %
% Yield = (1,6 gr / 3,9754 gr) x 100% = 90,25%
Pembahasan
Praktikum kali ini ialah tentang sintesis 4, 4′ – Dihidroksi -1, 1′ – Binaftil dan 2, 2′ – Dihidroksi – 2, 2′ binaftil melalui mekanisme oksidasi kopling. Prinsip reaksi oksidasi kopling ialah terjadi suatu reaksi penggabungan dengan senyawa sejenis dan berlangsung reaksi oksidasi. Reaksi oksidasi kopling ini digunakan untuk senyawa tersebut dengan katalis asam FeCl3 dari Naftol.
Hal yang dilakukan pada praktikum ini pertama ialah melarutkan α – Naftol dalam air panas untuk mempercepat kelarutannya lalu ditambah FeCL3. FeCl3 berperan sebagai katalis asam lewis yang dapat mempercepat reaksi. Setelah itu dilakukan penyaringan dengan buchner.
Padatan yang didapat ditambah benzen sebagai pelarut dan di refluks selama 5 menit. Fungsi refluks ialah untuk mempercepat reaksi dengan prinsip pemanasan sistem tertutup sehingga tak ada massa zat sistem yang keluar akibat menguap karena ketika zat akan pergi menguap, akan terjadi kondensasi dan kembali lagi pada sistem. Setelah itu disaring dan dicuci dengan benzena hangat. Benzena sama dengan pelarutnya oleh karena itu digunakan
Kemudian di rekristalisasi dengan etanol;air (8;2). Etanol dan air dapat menarik pengotornya. Dari hasil rekristalisasi didapat endapan sebesar 1,6 gr. Reaksinya:
Namun dari kesalahan relatif disimpulkan bahwa terjadi kesalahan yang belum diketahui pastinya. Namun ada beberapa kemungkinan yang terjadi yaitu preparasi bahan yang tak sesuai, ketidak telitian dalam penambahan zat, pengkondisian yang kurang tepat juga dapat menyebabkan reaksi yang tak sempurna.
Kesimpulan
- Massa produk yang didapat 1,6 gr
- FeCl3 digunakan sebagai katalis asam lewis
- Benzena digunakan untuk pelarut karena memiliki perbedaan kepolaran dengan zat terlarut
Daftar Pustaka
- Fessenden & Fessenden. 1986. Kimia Organik edisi 3. Jakarta : Erlangga
- Sykes, Peter. 1989. Penuntun Mekanisme Reaksi Organik. Jakarta : Erlangga
- Tim KBI Organik. 2011. Praktikum Sintesis Organik. Depok : Deptartemen Kimia FMIPA UI