Hidrolisis Garam merupakan pelajaran lanjutan untuk yang sudah mempelajari asam basa. Karena nantinya kita akan mempelajari hidrolisis garam yang terbentuk akibat campuran antara asam dan basa. Sebelum masuk pada penjelasan mengenai hidrolisis garam. Ada baiknya kita mengenal apa itu hidrolisis.
Hidrolisis berasal dari gabungan kata Hidro dan lisis. Hidro ini berarti air dan lisis berarti pecah/hancur. maka hidrolisis ini bisa diartikan dengan pecahnya air menjadi senyawa punyusunnya seperti H+ dan OH-. Namun karena disini ialah hidrolisis garam maka ada sedikit perbedaan. Garam terbentuk ketika terjadi reaksi antar asam dan basa.
Ketika kita melarutkan garam ke dalam air. maka ada beberapa hal yang mungkin terjadi.
1. Asam lemah dan Basa Lemah
Ion-ion yang berasal dari asam lemah (misalnya CH3COO–, CN–, dan S2–) atau ion-ion yang berasal dari basa lemah (misalnya NH4+, Fe2+, dan Al3+) akan bereaksi dengan air. Reaksi suatu ion dengan air inilah yang disebut hidrolisis. Contohnya : CH3COO– + H2O –> CH3COOH + OH–
2. Asam Kuat dan Basa Kuat
Ion-ion yang berasal dari asam kuat (misalnya Cl–, NO3–, dan SO42–) atau ion-ion yang berasal dari basa kuat (misalnya Na+, K+, dan Ca2+) tidak bereaksi dengan air atau tidak terjadi hidrolisis. Contohnya : Na+ + H2O —-> tak terjadi reaksi
Jadi perlu diingat bahwa hidrolisis terjadi pada campuran antara asam/basa kuat dengan asam/basa lemah atau sesama asam dan basa lemah. Hidrolisis tidak terjadi pada garam netral dari campuran asam dan basa kuat.
- Asam Kuat + Basa lemah —-> Garam asam (Hidrolisis Parsial)
- Asam Lemah + Basa Kuat —> Garam Basa (Hidrolisis Parsial)
- Asam Lemah + Basa Lemah —> Garam asam/basa tergantung harga Ka den Kb (Hidrolisis Total)
- Asam Kuat + Basa Kuat —> Garam Netral (Tidak terhidrolisis)
Perlu di ketahui bahwa:
Kh = Tetapan Hidrolisis | Kw = Tetapan Air(10-14) | Kb = Tetapan Basa
Perhitungan Garam Asam
Perhitungan Garam Basa
Perhitungan pH tetap menggunakan perhitungan normal asam basa seperti pada artikel perhitungan asam basa . dan dalam menentukan reaksi dan stoikiometri maka bacalah dulu artikel pendukung reaksi pembatas
Referansi :
http://www.chem-is-try.org/materi_kimia/kimia_sma1/kelas-2/hidrolisis/
http://marishaneli3103.wordpress.com/chem-xi/hidrolisis-garam/

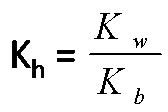

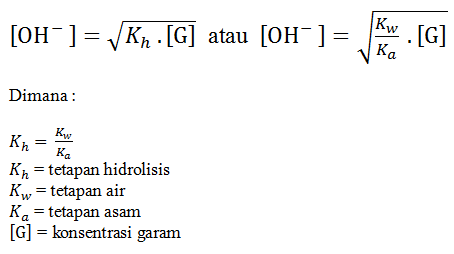



Kereeen
Terima kasih udah mampir. 🙂
Klik, ada lebih dari 50 soal
[…] Editor’s Note: Artikel ini merupakan penjelasan lebih lanjut dari artikel sejenis yang lebih sederhana tentang hidrolisis […]
[…] F. Hidrolisis Garam […]
Kak, saya mau tanya, diketahui larutan 100 ml asam sulfat dg pH =2 diencerkan sampai dengan volume 1 liter. Tentukan pH larutan yang terbentuk !
Kak tanya, dalam gelas kimia terdaat 1 liter laritan (CH3COOH)Ca 0,02 M Ka asam asetat 10^-5 berapaPh larutan tersebut. Terimakasih ditunggu jawabnnya
terima kasih banyak gan
Min, bagaimana jiika ingin menentukan tetapan hidrolisis dari garam yang berasal dari asam lemah dan basa lemah? Jadi di soalnya ditanya tetapan hidrolisis tapii diketahui Ka dan Kb nya? Mohon bantuannya min…
ada disini , https://bisakimia.com/2014/01/11/hidrolisis-garam/
Ka dan Kb di pakai untuk melihat sifat garamnya, termasuk asam atau basa
2). Suatu garam NH4CL (Mr = 53,5) sebanyak 10,7 gram dilarutkan dalam air hingga volumenya 400 mL
a. Tentukan konsentrasi larutan NH4CL !
b. Jika Kb NH4OH = 1,8 x 10^-5, tentukan pH larutan garam !