Perkembangan Teori Atom dan Bilangan Kuantum
Perkembangan Teori Atom
- Perkembangan Atom Dalton mengemukakan bahwa Atom merupakan bagian terkecil dari suatu unsur
- Perkembangan atom Rutherford mengemukakan bahwa atom terdiri atas inti atom yang bermuatan positif dan dikelilingi elektron yang bermuatan negatif pada lintasan tertentu.
- Teori atom Niels Bohr. Bohr sendiri mengemukakan bahwa elektron dalam atom beredar pada lintasan-lintasan dengan tingkat energi tertentu tanpa memancarkan atau menyerap energi. Perpindahan elektron dari tingkat energi rendah ke tingkat energi yang lebih tinggi disertai penyerapan atau absorbsi energi, demikian pula sebaliknya.
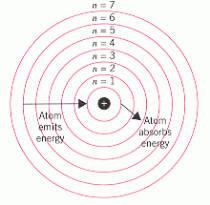
Model Atom Niels Bohr - Model atom Mekanika Gelombang
Teori Mekanika Gelombang dikemukakan oleh Max Planck, De Broglie, Schrodinger, dan Heisenberg
1. Teori Kuantum Max Planck (1990)
Teori ini menyatakan bahwa :
- Energi radiasi yang diserap maupun dipancarkan oleh suatu benda memiliki sifat diskrit dalam bentuk kelipatan satuan energi yang disebut kuantum
- Energi dari setiap kuantum sebanding dengan frekuensi radiasi yang dipancarkan atau diserap
![]()
2. Louis Victor de Broglie (1924)
Tokoh ini menyatakan tentang teori dualisme partikel gelombang : elektron memiliki sifat sebagai partikel sekaligus sebagai gelombang.
3. Erwin Schrodinger (1926)
Tokoh ini berpendapat bahwa kedudukan elektron dalam atom tidak dapat ditentukan dengan pasti, namun yang dapat ditentukan yaitu kebolehjadian menemukan elektron pada suatu titik pada jarak tertentu yang berasal dari intinya. Ruangan yang mempunyai kebolehjadian paling besar ditemukan pada elektron disebut orbital.
4. Werner Heisenberg (1927)
Tokoh ini berpendapat bahwa kedudukan dan momentum elektron tidak dapat ditentukan dengan tepat secara bersamaan yang dikenal dengan Asas Ketidakpastian.
B. Bilangan Kuantum
Bilangan kuantum digunakan untuk menyatakan kedudukan elektron pada suatu orbital. Macam-macam bilangan kuantum ada 4 yaitu :
1. Bilangan kuantum Utama (n)
- Menunjukkan tingkat energi utama atau kulit elektron dalam atom

Hubungan Jumlah Sub kulit dengan kulit - Harga n = 1,2,3,…,7. Untuk kulit K, L, M, N,…, Q
2. Bilangan kuantum azimut (l)
- Menunjukkan kedudukan elektron pada sub kulit
- Harga l = 0,1,2,……, (n-1)
- l=0, menyatakan sub kulit s (sharp : tajam)
- l=1, menyatakan sub kulit p (principal : utama)
- l=2, menyatakan sub kulit d (diffuse : kabur)
- l=3, menyatakan sub kulit f (fundamental : dasar)
3. Bilangan kuantum magnetik (m)
- Bilangan kuantum magnetik menyatakan arah orientasi orbital di dalam ruang relatif terhadap orbital lain.
- Harga bilangan kuantum magnetik (m) : antara
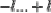
4. Bilangan kuantum spin (s)
- Menunjukkan arah putaran elektron terhadap sumbu orbitnya
- Harga s = ± 1/2
- Tanda +1/2 : arah putaran eletron berlawanan arah jarum jam, arah medan gravitasi magnet ke atas
- Tanday -1/2 : arah putaran elektron searah jarum jam, arah medan magnet ke bawah
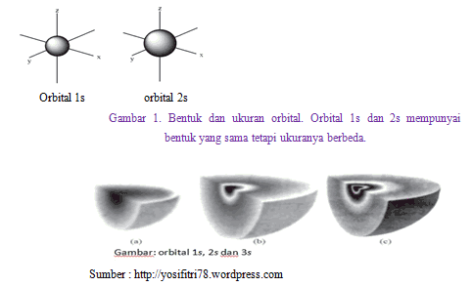
Bentuk-bentuk orbital
- Subkulit s, tersusun dari sebuah orbital dengan bilangan kuantum
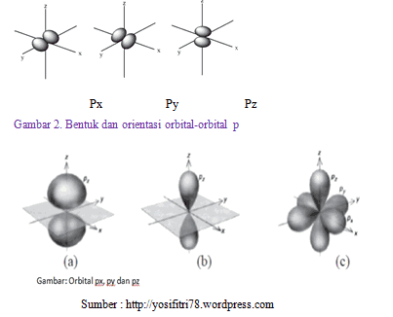
- Subkulit p, tersusun dari tiga orbital dengan bilangan kuantum . Tiga orbital p adalah px, py, dan pz
- Subkulit d, tersusun dari lima orbital dengan bilangan kuantum . Arah orientasi orbital d dibedakan menjadi orientasi di antara sumbu dan orientasi pada sumbu
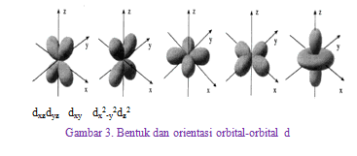
Sumber :Modul Kimia kelas XI, Penerbit Hayati



