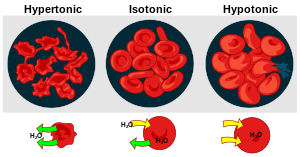
Berikut ialah beberapa soal mengenai tekanan osmotik yang ditanyakan oleh para pembaca. Disini akan dilakukan pembahasan mengenai soal tersebut karena pada tanya jawab hanya di berikan tips dan petunjuk mengerjakan soal.
1. Berapa gr urea CO(NH2)2 yg terlrut dlm 200mL larutan agar isotonik dengan 18 gr glukosa, C2H12O6 yg terlarut dlm 500mL pd keadaan yg sama? (Ar C=12, O=16, N=14, H=1).
Jawab:
isotonik menyatakan kondisi dimana terjadi kesamaan tekanan osmotik jadi π1=π2
anggap π1 untuk larutan glukosa dan π2 untuk larutan urea. diketahui rumus tekanan osmotik yaitu :
π=MRTi namun karena urea dan glukosa bukan elektrolit maka i=1
π1=π2 ——-> M1RT = M2RT ( T dan R dianggap sama)
M1 = M2 ——> (18gr/132)/0,5 L = (xgr/60)/0,2 L ——–> x = 3,27 gr
2. Tekanan osmotik rata2 dr darah adalah 7,7 atm 25 derjt C. Berapakah konsentrasi glukosa (C6 H12 O6) akan isotonik (tekanan sama) dgn darah?
Jawab :
Hampir sama seperti pertanyaan no.1
pertama tama kita beri perumpamaan dahulu π1 = tekanan larutan glukosa π2= tekanan darah
π1=π2
MRT = 7,7 atm
xM . (0,082 L atm mol–1K–1) . 298 K = 7,7 atm
x = 0,31 M
3. Seorang pasien memerlukan
larutan infus glukosa. Bila kemolaran cairan tsb 0,3 molar pada suhu tubuh 37 derajat C, tentukan tekanan osmotiknya! (R=0,082 L atm mol-1K-1)
Jawab :
π = MRT
π = 0,3 mol/L . (0,082 L atm mol–1K–1) . 310K
π = 7,62 atm
- larutan glukosa 2 M isotonik dengan larutan CH3COOH 1,5 M. Derajat ionisasi larutan asam asetat tersebut adalah ??(Kb=0,52¤C/m)
Jawab :
asam asetat termasuk elektrolit lemah sehingga rumusnya π = MRTi dimana i=(1+(n-1)α)
umpamakan π1 = tekanan os. glukosa dan π2 = tekanan os. asam asetat
π1 = π2
M1RT = M2RTi ——————– R dan T bisa dihilangkan
2 = 1,5 . (1+(n-1)α) ——— n = 2 ( merupakan jumlah ion dari ionisasi asam asetat = CH3COO- dan H+
2 = 1,5 . (1+1α) ——> 2 = 1,5 + 1,5α
α = 3
demikian pembahasan dari beberapa soal tentang tekanan osmotik yang di tanyakan oleh pembaca. Silahkan komentar jka ada koreksi atau pertanyaan.




ehh, derajat ionisasinya bukannya 0,3 ya?
Coba mas 0,3 darimana? Nanti biar kita lihat benar dan salahnya dimana? 🙂
iya seharusnya derajat ionisasinya 0,3. Karena n=2 maka (1+(2-1)α) = (1+α). 2=1,5(1+α) ; 2=1,5+1,5α ; 2-1,5=1,5α ; α=0,5/1,5= 0,3
Terima kasih ya. Sudah d update
Sy ada soal sbb: suatu zat elektrolit biner dengan konsentradi 0.3M memiliki tekanan osmotik yg sama (isotonik) dgn laritan yg dibuat dr 300gram urea volume 1 litet. Berapa derajat ionisasi elektrolit tsbt? Mohon penyelesaiannya. Trm ksih.
Saya ada soal mz.
Larutan H3PO4 1M isotonis dengan larutan Urea 2M pada suhu yg sama. Hitunglah berapa % larutan H3PO4 yg terionisasi dalam larutan..
Terima Kasih mz..
Numpang tanya hasil no*1
122 dan 60 itu darimana?
Itu Mr dari Urea dan Glukosa
Assalamualaikm dan slamat pagi bpk krisnadi. Mu memastikaan aj nih. Soal no.1 otu Mr dari C2H12O6 kok =122?
bukanya 132?
ini buktinya
C2H12O6
C=2×ArC=2×12=24
H=12×ArH=12×1=12
O=6×ArO=6×16=96
________________+
Mr C2H12O6=132
Terimakash . Mohon dijawaby pak 😊
Wa’alaykumussalam erni. Terima kasih banyak atas koreksinya. Sepertinya ada kesalahan perhitungan. Akan saya update sekarang 🙂
Iya sama” bpk. Saling mengingtkn pak 😊
Assalamualaikm dan slmt sore pak 😊 bpk bisa kasih contoh soal yg zat terlarutnya elektrolitkah pak? Jdi bisa ad faktor vant hoff ny. Kenbanyakan diartikel2 lainnjuga cumanyg non elektrolit.
Trmakash bpk 🙏
Wa’alaykumussalam. Terima kasih masukannya. Nanti di Jadwal kan untuk update. Tapi kamu kalau mau ngasih contoh nanti saya jdiin kontributor boleh
Btw Kontributor itu apa yah pak😅.alhmdulillah udh dapat ini contohny
Maksudnya jd penulis disini. Nanti tulis soal soal dan pembahasan. Hehehe
Oalah baru tau pak 😂. Oh boleh” pak ..ilmu yg manfaat itu kan ilmu yg berguna buat yg lain juga 😊
Nti klau udh jdwalny bpk bilang aj
pagi ini ya saya invite
Kalau sdh jadwalny nulis bpk blng aj
Ada wa kh pak
Ada 085217391557
larutan manakah yang mengandung ion k+ lebih banyak larutan kbr 15 atau kcl 12
larutan manakah yang mengandung ion k+ lebih banyak larutan kbr 15 atau kcl 12
itu 12 dan 15 apa maksudnya ? mol apa M ?