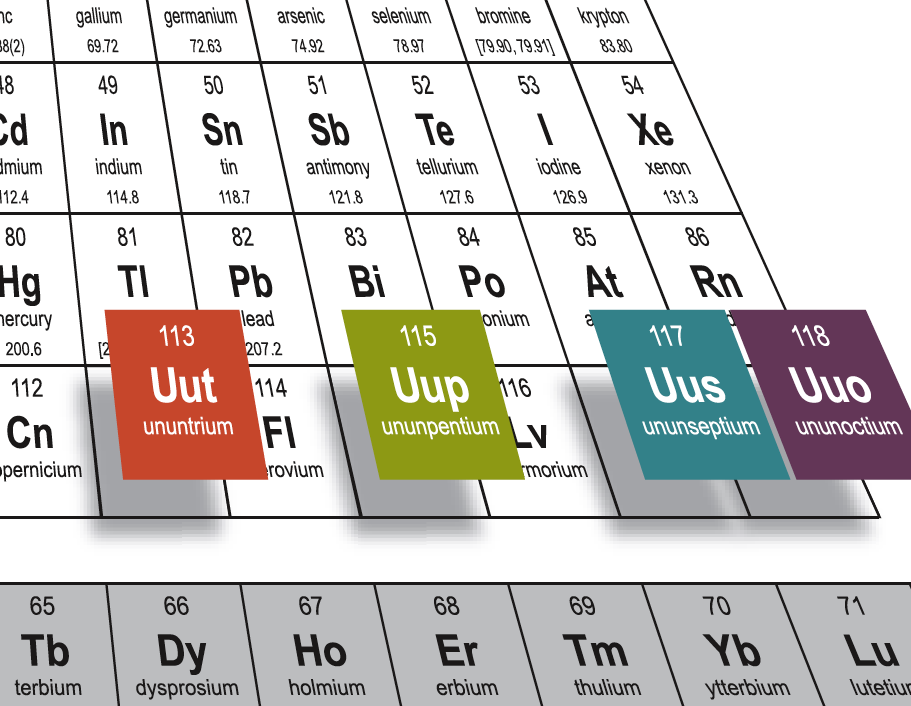
Unsur merupakan zat tunggal yang tidak dapat diuraikan lagi menjadi zat lain yang lebih sederhana. Di alam, unsur-unsur biasanya terdapat dalam bentuk senyawa, seperti, hidrogen yang terdapat pada air, oksigen dan nitrogen yang terdapat pada udara. Berdasarkan sifatnya, unsure dibagi menjadi 3 yaitu :
Unsur logam
Ciri-ciri unsur logam sebagai berikut :
- Mengkilap
- Penghantar panas dan listrik yang baik
- Bersifat keras dan dapat ditempa
- Pada umumnya wujudnya padat, kecuali raksa. Contoh : besi, emas, dan perak.
Unsur Nonlogam
Cirinya :
- Tidak menghantarkan listrik ataupun panas
- Tidak mengkilap
- Sifatnya rapuh
- Ada yang berwujud padat, cair, maupun gas. Contoh : karbon, belerang, dan oksigen
Metaloid
Unsur yang memiliki sifat logam dan nonlogam. Contohnya adalah seperti silikon dan arsenium.
Dari masa ke masa, maka dimulailah perkembangan dari sistem periodik unsur dengan mengadakan berbagai macam sebagai berikut :
A. Pengelompokkan Unsur (logam dan nonlogam)
Berdasarkan sifat kemiripan fisik, unsur-unsur dikelompokkan menjadi 2 yaitu :
- Unsur logam . Contohnya adalah seperti besi, emas, dan tembaga
- Unsur non logam. Contohnya adalah seperti karbon, belerang, oksigen dan nitrogen.
B. Hukum Triade Dobereiner (1829)
Hukum ini dikemukakan oleh Johann Wolfgang Dobereiner. Hukum ini berbunyi, :Jika tiga unsur di dalam triade disusun menurut kenaikan massa atomnya, massa atom unsur di tengah (ke-2) sama dengan massa atom rata-rata unsur ke-1 dan ke-3.” Ketiga unsur yang memiliki kemiripan sifat ini disebut unsur triade. Berikut ini adalah daftar unsur triade Dobereiner.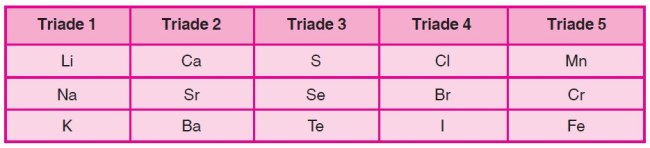
C. Hukum Oktet Newlands (1863)
Hukum OKtet dari Newlands berbunyi, “Jika unsur-unsur disusun berdasarkan kenaikan massa atomnya, sifatnya akan berubah secara teratur atau periodik”. Artinya sifat-sifat unsur akan terulang lagi pada setiap unsur ke-8, sifat unsur ke-8 mirip dengan unsur ke-1. Kelemahan hukum ini : pengulangan setiap delapan unsur hanya cocok untuk unsur-unsur yang massa atomnya kecil. Berikut ini adalah daftar unsur oktet dari Newlands.
D. Sistem Periodik Mendeleyef dan Lothar Mayer (1896)
Mendeleyef dan Lothar Mayer menggolongkan unsur-unsur berdasarkan massa atom dan sifat-sifat yang menghasilkan daftar unsur hampir sama. Lothar Mayer menggolongkan unsur berdasarkan sifat kimia unsur, sedangkan Mendeleyef berdasarkan kenaikan massa atom relatifnya. Bunyi hukum dari Mendeleyef, “Sifat-sifat unsur merupakan fungsi periodik dari massa atom relatifnya.” Susunan Mendeleyef merupakan sistem periodik pertama, biasanya disebut dengan sistem periodik unsur bentuk pendek.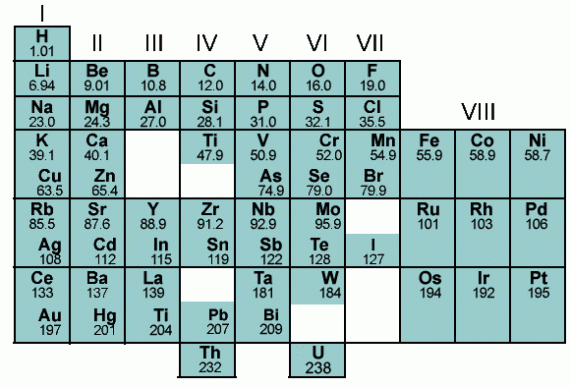
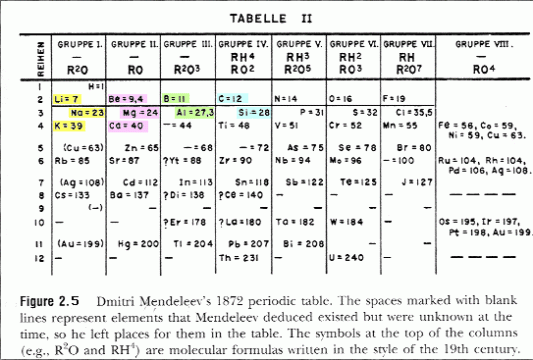
Pada lajur tegak disebut golongan dan lajur mendatar disebut dengan periode.
Kelemahan hukum periodik Mendeleyef adalah adanya tempat-tempat kosong dalam tabel periodik yang terbentuk atau hukum periodik tidak terpenuhi.
Kelebihannya adalah unsur-unsur yang belum ditemukan dapat diramalkan sifat-sifatnya secara tepat.
2 poin lagi silahkan melanjutkan ke halaman 2



