Kepolaran suatu senyawa sebenarnya ialah pemahaman dasar yang harus dimengerti ketika kita telah mempelajari kimia
lebih dalam. Bahkan dalam artikel tentang ikatan telah sedikit dibahas kepolaran suatu zat dan pengertiannya secara singkat.
Namun masih banyak yang bingung tentang kepolaran suatu zat/senyawa. oleh karena itu kita akan bahas lagi dengan lebih detail hingga semuanya mengerti.
Polar sendiri berasal dari kata pole yakni kutub. jadi maksudnya senyawa polar ialah yang memiliki 2 kutub. Kutub apa saja itu dan bagaimana maksudnya?
Kutub pertama kutub negatif dan yang kedua ialah kutub positif. Hal ini terjadi akibat adanya unsur unsur dengan keelektronegatifan yang tinggi dan keelektronegatifan yang rendah dalam 1 senyawa. Bagi yang belum tahu tentang keelektronegatifan, akan saya jelaskan terlebih dahulu. kalau yang sudah, bisa langsung melangkah sedikit kebawah 🙂 . elektronegatif ialah sifat suatu unsur yang suka/cenderung menarik elektron dari atom lain. semakin tinggi sifat elektronegatifnya maka akan semakin kuat tarikannya terhadap elektron lain. Pada tabel periodik, semakin ke kanan maka keelektronegatifan lebih tinggi. (tren keelektronegatifan tabel periodik lihat pembahasannya disini) Namun gas mulia tidak termasuk yang elektronegatif karena gas mulia telah stabil. Misalnya saja atom H dan atom Cl. tentu saja Cl lebih elektronegatif daripada H.
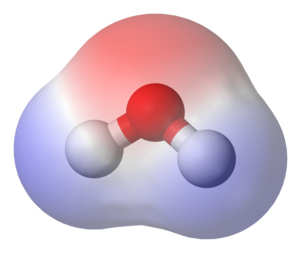
Selanjutnya, Jika atom atom seperti H dan O tersebut membentuk senyawa dengan pola tertentu maka akan terbentuklah senyawa yang polar. misalnya saja
H-O-H (senyawa ini memiliki bentuk /\ , namun karena keterbatasan input maka saya gambarkan secara lurus)
H—–O—–H tarikan elektronnya bergerak ke dari H ke O
maka O menjadi kutub negatif karena memiliki banyak elektron, H akan menjadi kutub positifnya
Penjelasan senyawa non Polar silahkan lanjut di halaman 2 ya




[…] kepolaran sebelumnya telah dibahas juga pada artikel memahami kepolaran senyawa, namun pada kali ini kita akan membahas bagaimana hubungan antara kovalen dengan kepolaran. Seperti […]
[…] dipol-dipol merupakan gaya yang bekerja antara molekul – molekul polar. yaitu antara molekul yang memiliki momen dipol. Semakin besar momen dipolnya, maka sebakin kuat […]
Bagaimana mengubah senyawa non polar menjadi polar???
Polar dan non polar merupakan sifat dari suatu senyawa yang timbul akibat sifat sifat atom penyusunnya.
Jadi kita tidak bisa mengubahnya.
Yang bisa kita lakukan hanyalah menularkan sedikit sifat kepolaran dari zat lain. Hal ini yang biasa di sebut gaya london
[…] tidak bercampur karena kepolarannya yang berbeda(yang belum paham tentang kepolaran, bisa lihat disini). Corong pisah ini biasa juga di gunakan untuk melakukan pemisahan ekstraksi. Pemisahan dengan […]
[…] melarutkan pengotor non polar, Sedangkan air berfungsi untuk melarutkan pengotor yang bersifat polar. Tetapi kali ini hanya akuades yang digunakan untuk […]
[…] Cairan NonPolar (tentang kepolaran pelajari disini ya) […]
[…] dipol-dipol merupakan gaya yang bekerja antara molekul – molekul polar. yaitu antara molekul yang memiliki momen dipol. Semakin besar momen dipolnya, maka sebakin kuat […]