
pH suatu larutan akan turun apabila ditambah asam, hal ini disebabkan meningkatnya konsentrasi H+. Sebaliknya, bila ditambah basa akan menaikkan pH karena penambahan basa meningkatkan konsentrasi OH–. Penambahan air pada larutan asam dan basa akan mengubah pH larutan, karena konsentrasi asam atau basanya akan mengecil. Namun, ada larutan yang bila ditambah sedikit asam, basa, atau air tidak mengubah pH secara berarti. Larutan yang demikian disebut dengan larutan penyangga (disebut juga larutan buffer atau dapar). Larutan buffer memiliki komponen asam yang dapat menahan kenaikan pH dan komponen basa yang dapat menahan penurunan pH. Komponen tersebut merupakan konjugat dari asam basa lemah penyusun larutan buffer itu sendiri. Dengan demikian, larutan penyangga merupakan larutan yang dibentuk oleh reaksi suatu asam lemah dengan basa konjugatnya ataupun basa lemah dengan asam konjugatnya. Reaksi ini disebut sebagai reaksi asam-basa konjugasi. (Keenan et al., 1980)
Secara umum, larutan penyangga digambarkan sebagai campuran yang terdiri dari:
- Asam lemah (HA) dan basa konjugasinya (ion A–), campuran ini menghasilkan larutan bersifat asam.
- Basa lemah (B) dan basa konjugasinya (BH+), campuran ini menghasilkan larutan bersifat basa. (Purba, 1994)
Komponen larutan penyangga terbagi menjadi (Keenan et al., 1980):
- Larutan penyangga yang bersifat asam
Larutan ini mempertahankan pH pada daerah asam (pH < 7). Larutan ini dapat dibuat dari asam lemah dan garamnya (yang merupakan basa konjugasi dari asamnya). Adapun cara lainnya yaitu mencampurkan suatu asam lemah dengan suatu basa kuat, asam lemahnya dicampurkan dalam jumlah berlebih. Campuran akan menghasilkan garam yang mengandung basa konjugasi dari asam lemah yang bersangkutan. Pada umumnya basa kuat yang digunakan seperti natrium hidroksida, kalium hidroksida, barium hidroksida, kalsium hidroksida, dan lain-lain.
- Larutan penyangga yang bersifat basa
Larutan ini mempertahankan pH pada daerah basa (pH > 7). Larutan ini dapat dibuat dari basa lemah dan garam (yang berasal dari asam kuat). Adapun cara lainnya yaitu: mencampurkan suatu basa lemah dengan suatu asam kuat dimana basa lemahnya dicampurkan berlebih.
Adapun sifat-sifat larutan penyangga diketahui sebagai berikut (Syukri, 1999):
- Mempunyai pH tertentu
pH buffer dapat dicari dengan persamaan Henderson-Hasselbalch, yaitu:
pH = pKa + log [garam]/[asam]
pOH = pKb + log [garam]/[basa]
pH buffer bergantung pada Ka asam lemah atau Kb basa lemah dan perbandingan konsentrasi asam dengan konsentrasi basa konjugasinya atau konsentrasi basa lemah dengan konsentrasi asam konjugasinya. Persamaannya (Purba, 1994):
a. Reaksi ionisasi asam lemah:
HA(aq) ↔ H+(aq) + A–(aq)
Tetapan ionisasinya dilambangkan dengan Ka
Ka = [H+][A–] / [HA]
b. Reaksi ionisasi basa lemah:
LOH(aq) ↔ L+(aq) + OH–(aq)
Tetapan ionisasinya dilambangkan dengan Kb
Kb = [L+][OH–] / [LOH]
- pHnya relatif tidak berubah jika ditambah sedikit asam atau basa.
-
pHnya tidak berubah jika diencerkan.
Telah disebutkan bahwa larutan penyangga mengandung komponen asam dan basa dengan asam dan basa konjugasinya, sehingga dapat mengikat baik ion H+ maupun ion OH–. Sehingga penambahan sedikit asam kuat atau basa kuat tidak mengubah pH-nya secara signifikan. Berikut ini cara kerja larutan penyangga (Syukri, 1999):
Larutan penyangga asam
Sebagai contoh cara kerjanya dapat dilihat pada larutan buffer yang mengandung CH3COOH dan CH3COO– yang mengalami kesetimbangan. Prosesnya sebagai berikut:
– Pada penambahan asam
Penambahan asam (H+) akan menggeser kesetimbangan ke kiri. Ion H+ yang ditambahkan akan bereaksi dengan ion CH3COO– membentuk molekul CH3COOH.
CH3COO–(aq) + H+(aq) → CH3COOH(aq)
– Pada penambahan basa
Jika yang ditambahkan adalah suatu basa, maka ion OH– dari basa itu akan bereaksi dengan ion H+ membentuk air. Hal ini akan menyebabkan kesetimbangan bergeser ke kanan sehingga konsentrasi ion H+ dapat dipertahankan. Jadi, penambahan basa menyebabkan berkurangnya komponen asam (CH3COOH), bukan ion H+. Basa yang ditambahkan tersebut bereaksi dengan asam CH3COOH membentuk ion CH3COO– dan air.
CH3COOH(aq) + OH–(aq) → CH3COO–(aq) + H2O(l)
Larutan penyangga basa
Sebagai contoh cara kerjanya, dapat dilihat pada larutan buffer yang mengandung NH3 dan NH4+ yang mengalami kesetimbangan. Prosesnya sebagai berikut:
– Pada penambahan asam
Jika ditambahkan suatu asam, maka ion H+ dari asam akan mengikat ion OH–. Hal tersebut menyebabkan kesetimbangan bergeser ke kanan, sehingga konsentrasi ion OH– dapat dipertahankan. Disamping itu, penambahan ini menyebabkan berkurangnya komponen basa (NH3), bukan ion OH–. Asam yang ditambahkan bereaksi dengan basa NH3 membentuk ion NH4+.
NH3 (aq) + H+(aq) → NH4+ (aq)
– Pada penambahan basa
Jika yang ditambahkan adalah suatu basa, maka kesetimbangan bergeser ke kiri, sehingga konsentrasi ion OH– dapat dipertahankan. Basa yang ditambahkan bereaksi dengan komponen asam (NH4+), membentuk komponen basa (NH3) dan air.
NH4+ (aq) + OH–(aq) → NH3 (aq) + H2O(l)
Untuk menghitung pH larutan buffer digunakan cara sebagai berikut (Purba, 1994):
- Larutan penyangga asam
Dapat digunakan tetapan ionisasi dalam menentukan konsentrasi ion H+ dalam suatu larutan dengan rumus berikut:
[H+] = Ka x a/g atau
pH = p Ka – log a/g
dengan, Ka = tetapan ionisasi asam lemah
a = jumlah mol asam lemah
g = jumlah mol basa konjugasi
- Larutan penyangga basa
Dapat digunakan tetapan ionisasi dalam menentukan konsentrasi ion H+ dalam suatu larutan dengan rumus berikut:
[OH–] = Kb x b/g atau
pH = p Kb – log b/g
dengan, Kb = tetapan ionisasi basa lemah
b = jumlah mol basa lemah
g = jumlah mol asam konjugasi
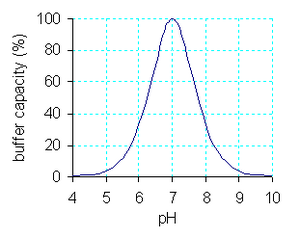
Menurut Syukri (1999), larutan buffer juga mempunyai kapasitas buffer (yang biasa disebut indeks buffer atau intensitas buffer). Kapasitas buffer merupakan suatu ukuran kemampuan buffer untuk mempertahankan pHnya yang konstan apabila ditambahkan asam kuat atau basa kuat. Kapasitas buffer bergantung pada jumlah asam-garam atau basa-garam yang terkandung di dalamnya. Apabila jumlahnya besar, pergeseran kesetimbangan ke kanan maupun ke kiri dapat berlangsung banyak untuk mengimbangi asam kuat atau basa kuat yang ditambahkan. Sehingga dapat disebut kapasitas buffernya besar. Sebaliknya apabila jumlah asam-garam atau basa-garam itu kecil, dapat menyebabkan pergeseran kesetimbangan ke kanan dan ke kiri berlangsung sedikit. Sehingga dapat dikatakan kapasitas buffernya kecil. Suatu buffer dapat menahan perubahan [H+] sebanyak 100x semula. Perubahan pH yang diizinkan hanyalah sekitar 2. Ka atau Kb adalah konstanta, maka suatu buffer hanya efektif pada daerah pH tertentu yang disebut rentang daerah buffer. Sesungguhnya penambahan asam/basa pada suatu buffer akan mengubah pH-nya, namun perubahan itu sangatlah kecil dan dapat diabaikan. Namun, jika jumlah asam/basa yang ditambahkan makin banyak, maka perubahan pH-nya tak dapat diabaikan lagi. Jumlah asam atau basa yang dapat dinetralkan suatu buffer sebelum pH larutan berubah disebut kapasitas buffer .
Kapasitas/daya tahan larutan penyangga bergantung pada jumlah mol dan perbandingan mol dari komponen penyangganya. Semakin banyak jumlah mol komponen penyangga, semakin besar kemampuannya mempertahankan pH. Apabila komponen asam terlalu sedikit, penambahan sedikit basa dapat mengubah pHnya. Sebaliknya apabila komponen basanya terlalu sedikit, penambahan sedikit asam dapat mengubah pHnya. Sedangkan, perbandingan mol antara komponen-komponen suatu larutan penyangga sebaiknya antara 0,1-10. Di luar perbandingan tersebut, maka sifat penyangganya akan berkurang (Keenan et al., 1980).
Larutan penyangga ini dapat dilihat dalam kehidupan sehari-hari seperti pada obat-obatan, fotografi, industri kulit dan zat warna. Selain aplikasi tersebut, terdapat penerapan konsep larutan penyangga ini dalam tubuh manusia, contohnya seperti pada cairan tubuh. Cairan tubuh (baik cairan intrasel maupun cairan ekstrasel) merupakan larutan penyangga. Sistem penyangga yang utama dalam cairan intrasel adalah pasangan dihidrogenfosfat-monohidrogenfosfat (H2PO4– -HPO42-). Sedangkan sistem penyangga yang utama dalam cairan ekstrasel adalah pasangan asam karbonat-bikarbonat (H2CO3 – HCO3–). Sistem penyangga ini dapat menjaga pH darah hampir konstan, yaitu sekitar 7,4 (Keenan et al., 1980).
Sumber:
Achmad, H. 2001. Penuntun Belajar Kimia Dasar : Kimia Larutan. Bandung: Citra Adhya Bhakti.
Keenan, C.W., Kleinfelter, D.C., Wood, J.H. 1980. General College Chemistry, 6th edition. Knoxville: Harper and Row Publisher, Inc.
Purba, M. 1994. Kimia untuk SMA kelas XI: 2B. Jakarta: Penerbit Erlangga.
Syukri, S. 1999. Kimia Dasar 2. Bandung : ITB Press.




[…] Larutan penyangga atau larutan buffer adalah larutan yang pH-nya relatif tetap (tidak berubah) pada penambahan sedikit asam atau sedikit basa. Ditinjau daru komposisi zat penyusunnya, sistem larutan penyangga dibagi menjadi dua, yaitu sistem penyangga asam dan basa konjugasinya serta sistem penyangga basa dan asam konjugasinya. Artikel lain mengenai larutan buffer juga bisa dilihat disini […]
[…] E. Larutan Penyangga […]
terima kasih kak ^^ sangat membantu 😀
Makasih buat materi ini karena dengan membaca materi ini, saya bisa menjawab soal soal tugas ku.
bukan ranah saya inii 🙂
but infonya menarik
terima kasih ya sudah mampir
Well, sangat membantu.. kalau bisa tambahkanh halaman untuk endnote nya biar lebih keren
terima kasih atas perhatiannya, saat ini penulisnya sudah tidak aktif, tapi mungkin nanti bisa saya tambahkan